Zwitterion
Synonym: inneres Salz
Englisch: zwitterion, dipolar ion
Definition
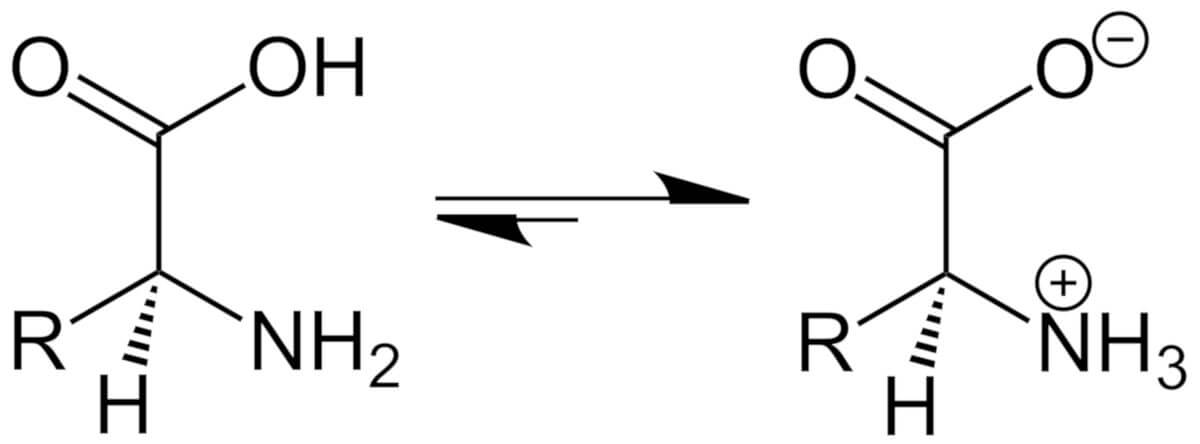
Als Zwitterion wird ein Molekül bezeichnet, das zwei oder mehrere funktionelle Gruppen enthält, wobei von diesen jeweils eine positiv und die andere negativ geladen sein muss. Da sich die Ladung dementsprechend ausgleicht, ist das Molekül insgesamt elektrisch neutral. In manchen Lehrbüchern wird auch der Begriff "inneres Salz" für die Bezeichnung als Zwitterion verwendet.
Chemie
In den meisten Fällen handelt es sich bei den funktionellen Gruppen um eine Säure- und eine Basenfunktion. Das bekannteste Beispiel im menschlichen Organismus sind Aminosäuren - sie sind sowohl in wässriger Lösung als auch in einer festen Phase in einem zwitterionischen Zustand. Grund dafür ist, dass der Säurerest ein Wasserstoffion abgibt und somit eine negative Ladung aufweist, zugleich aber die Aminogruppe ein Wasserstoffion aufnimmt und somit zu einer positiven Ladung gelangt. Diese Eigenschaft würde eigentlich an Betaine erinnern, jedoch haben Zwitterionen die Möglichkeit, ihre Ladung durch Protonenwanderung auszugleichen.
Weist eine Lösung einen bestimmten, exakt definierten pH-Wert auf, besitzen gleich viele Säuregruppen negative Ladungen wie Aminogruppen positive Ladungen aufweisen. Dieser pH-Wert wird auch als isoelektrischer Punkt (pI) bezeichnet. Es findet keine Wanderung der Aminosäuren im elektrischen Feld mehr statt. Anstelle der üblichen Bewegungen richten sich diese nur aus, da die Summenladung neutral ist (+ und - heben sich auf).
Medizinische Bedeutung
Erzeugt man einen pH-Wert, der unterhalb des isoelektrischen Punkts liegt, nimmt die Dissoziation der Säuregruppe ab und die Aminosäure trägt eine positive Summenladung. Liegt der pH-Wert jedoch über dem pI, so nimmt die Dissoziation der Säure hingegen zu, was dazu führt, dass die Aminogruppe das Wasserstoffion abgibt und das Molekül negativ wird.
Dieser Effekt wird in der Chemie und Biochemie bei der Elektrophorese und bei der isoelektrischen Fokussierung genutzt. Eine Aminosäure am isoelektrischen Punkt weist die geringste Wasserlöslichkeit auf, da aufgrund der dort enstandenen intramolekularen Ladung keine stabile Hydrathülle mehr gebildet werden kann.