Isoelektrischer Punkt
Synonyme: IEP, pI, iP, pHI
Englisch: isoelectric point
Definition
Der isoelektrische Punkt, kurz pI, ist ein exakt definierter pH-Wert einer wässrigen Lösung, bei dem sich bei Ampholyten oder Zwitterionen (z.B. Aminosäuren und Proteine) die positive und negative Ladung ausgleicht. Der pI ist somit eine für jedes einzelne zwitterionisch aufgebaute Molekül charakteristische Größe.
Hintergrund
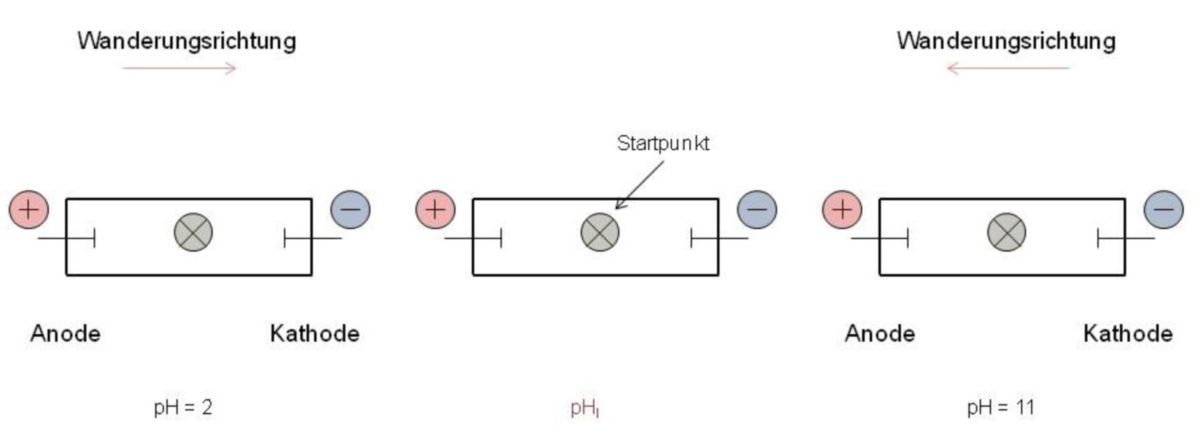
Leichter verständlich wird der isoelektrische Punkt mittels Durchführung einer Elektrophorese. Je nachdem, welcher pH-Wert herrscht, liegen die Anteile der verschieden geladenen Molekülformen einer Aminosäure in einer wässrigen Lösung vor. Beispiel: Es soll ein Filterpapierstreifen mit einer Pufferlösung angefeuchtet werden. Der pH-Wert der Lösung muss dabei bekannt sein. Man markiert anschließend in der Mitte des Streifens einen Startpunkt und trägt dort einen Tropfen Aminosäurelösung (z.B. Glycin) auf. Anschließend legt man an die Enden des Papierstreifens über geeignete Kontakte eine Gleichspannung an. Diesen Versuchsvorgang nennt man Papierelektrophorese. Nach einer gewissen Zeit enfernt man beide Elektroden und lässt den Papierstreifen trocknen und besprüht diesen mit einer Ninhydrinlösung (Regaenz auf Aminosäuren). Nach kurzem Erwärmen erscheint die Aminosäure als violetter Fleck und wird somit sichtbar.
Bei o.a. Elektrophorese wird Folgendes erkennbar: Liegt der pH-Wert bei 2, wandert die Aminosäure zur Kathode (-), da die Kationen überwiegen. Bei einem pH-Wert von 11 liegen hauptsächlich Anionen vor. Diese wandern in der Pufferlösung zur Anode (+). Bei einem ganz bestimmten pH-Wert entfernt sich die Aminosäure nicht vom Startfleck. Liegt eine solche Situation vor, herrscht ein isoelektrischer Zustand. Das heißt, dass die Zahl der negativen Ladungen gerade die Anzahl der positiven Ladungen kompensiert. In dieser Situation liegt die Aminosäure überwiegend als Zwitterion vor und erscheint nach außen hin elektrisch neutral. Daher entstehen innerhalb der Elektrophorese keinerlei Bewegungsabläufe. Wissenswert ist außerdem, dass am isoelektrischen Punkt jede Aminosäure die geringste Wasserlöslichkeit aufweist.
| Merke: |
|---|
| Als isoelektrischen Punkt versteht man den pH-Wert, bei dem der isoelektrische Zustand erreicht wird. Dieser Wert ist eine für jede Aminosäure charakteristische Konstante und vom pKs-Wert der funktionellen Gruppe abhängig. Neben den Aminosäuren besitzen auch Peptide und Proteine einen isoelektrischen Punkt. |
Am Beispiel Glycin lässt sich der dem isoelektrische Punkt entsprechende pH-Wert aus dem arithmetischen Mittel der beiden pKs-Werte berechnen.
Eine praktische Anwendung der pH-abhängigen Wanderung im elektrischen Feld ist die isoelektrische Fokussierung.
Berechnung
Um den pH-Wert am isoelektrischen Punkt genau ausrechnen zu können, muss man den pKs-Wert der Säuregruppe sowie der Aminogruppe berechnen:
pH = (pKs1 + pKs2) ÷ 2
Herleitung
Die Säurekonstanten werden wie folgt definiert:
- (1) Ks1 = c(H3O+) · [c(Zwitterion) ÷ c(Kation)]
- (2) Ks2 = c(H3O+) · [c(Anion) ÷ c(Zwitterion)]
Die Gleichung (1) löst man nach c (Zwitterion) auf und setzt anschließend das Ergebnis in die Gleichung (2) ein.
Ks1 · Ks2 = c(H3O+)2 · [c(Anion) ÷ c(Kation)]
Da die Konzentrationen von Anionen und Kationen am isoelektrischen Punkt ident sind, wird die Gleichung wie folgt vereinfacht:
Ks1 · Ks2 = c(H3O+)2
Anschließend wird die Wurzel gezogen und logarithmiert, worauf man zu folgender Gleichung kommt:
pH = (pKs1 + pKs2) ÷ 2
Beispiel
Enthält eine Aminosäure zusätzlich noch eine saure oder gar basische Gruppe im Rest R, werden zur Berechnung des isoelektrischen Punktes aus den pKS-Werten im ersten Fall nur die pKS-Werte der sauren und im zweiten Fall die der basischen Gruppe berücksichtigt.
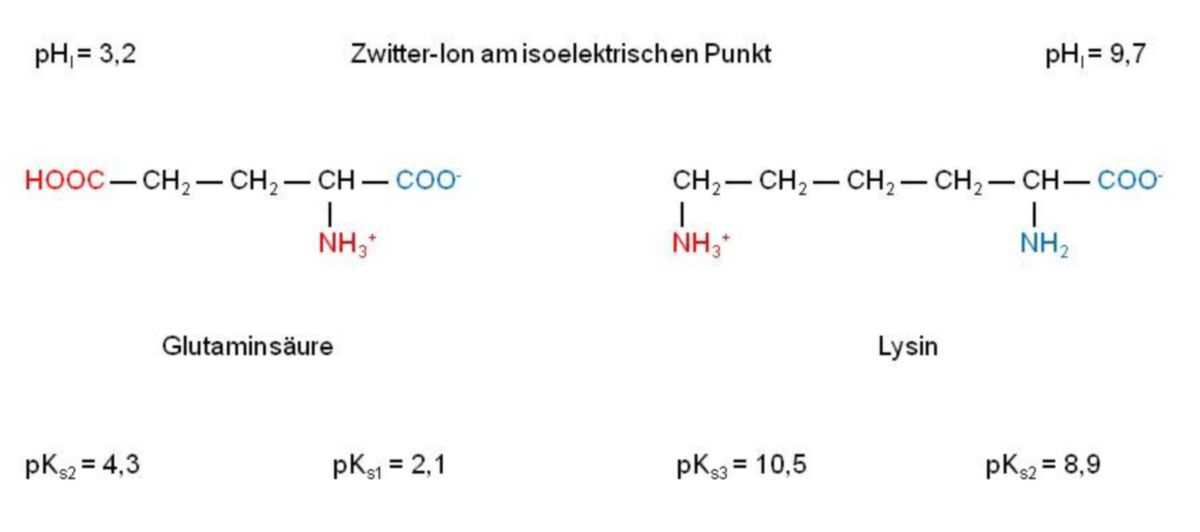
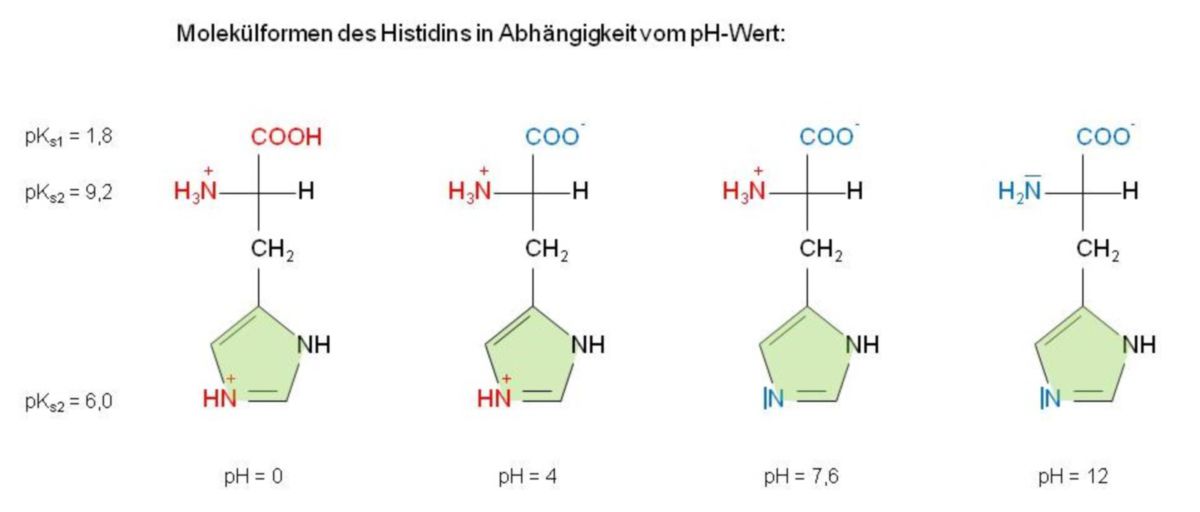
Betrachtet man die Glutaminsäure, so sieht man, dass sich der isoelektrische Punkt in den sauren Bereich (pHI = 3,2) verschiebt. Deshalb zählt man - gleich der Asparaginsäure - diese Verbindung zu den "sauren" Aminosäuren. Beim Lysin erfolgt genau das Gegenteil: Die Verschiebung findet in den alkalischen Bereich statt (pHI = 9,7) und deshalb spricht man hier von einer "basischen" Aminosäure. Dementsprechend werden Aminosäuren, die einen isoelektrischen Punkt zwischen pHI = 5 - 6,5 aufweisen, als "neutral" eingestuft (Glycin, Alanin, Phenylalanin und Glutamin). Das Histidin nimmt eine sogenannte Mittelstellung ein. Hier liegt der isoelektrische Punkt im schwach basischen Bereich (pHI = 7,6) und wie man sehen kann somit auch im physiologischen pH-Bereich. Das sich im Ring befindliche Stickstoffatom, das sich mit keinem Wasserstoffatom verbunden hat, ist schwach basisch (pKs = 6,0). Das heißt, dass im Bereich pH = 4 - 8 dieses N-Atom protoniert oder deprotoniert werden kann, was jedoch bei vielen Enzymreaktionen genutzt wird.