Glucose-6-phosphat-Dehydrogenase
Synonyme: Glukose-6-Phosphat-1-Dehydrogenase, Glukose-6-phosphat-Dehydrogenase
Englisch: glucose-6-phosphate dehydrogenase
Definition
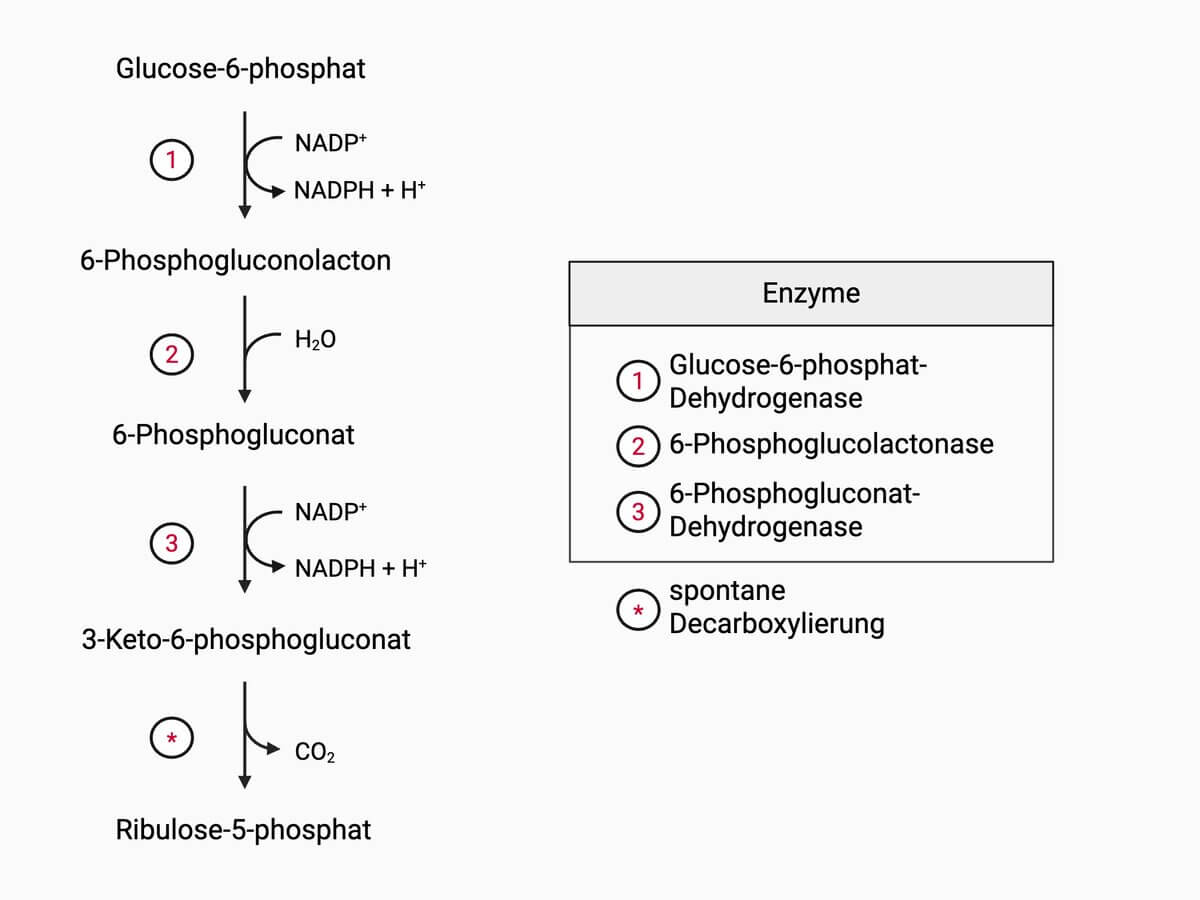
Die Glucose-6-phosphat-Dehydrogenase, kurz G6PD oder G6PDH, ist ein Enzym, das die Oxidation von Glucose-6-phosphat zu 6-Phosphogluconolacton und die gleichzeitige Reduktion von NADP+ zu NADPH katalysiert. Es ist das Schlüsselenzym für den oxidativen Anteil des Pentosephosphatwegs und zählt laut EC-Klassifikation zur Gruppe I (EC 1.1.1.49).
Genetik
Das G6PD-Gen ist auf dem X-Chromosom am Genlokus Xq28 (154.53 – 154.55 Mb) kodiert.
Biochemie
G6PD bildet zunächst Homodimere, die wiederum ein Homotetramer bilden. Das Enzym bindet zwei NADP+-Moleküle, wovon eines als Substrat und eines als strukturelles Element für die Enyzmstabiltität dient.
G6PD wird durch NADP+ allosterisch aktiviert und durch NADPH/H+ gehemmt. Weiterhin wird es durch ELP3 acetyliert. Diese Acetylierung verhindert die Dimerisierung und wirkt somit hemmend auf die Aktivität.
Insulin wirkt stimulierend auf die Transkription des G6PD-Gens.
Isoformen
G6PD kommt in zwei Isoformen vor. Die kurze Isoform besteht aus 514 Aminosäuren und hat eine molare Masse von 59 kDa. Sie findet sich vor allem in Erythrozyten sowie in der Leber. Die lange Isoform weist 560 Aminosäuren auf und ist vor allem in Lymphoblasten, Granulozyten und Spermatozyten vorhanden.
Funktion
G6PD katalysiert folgende Reaktion:
Klinik
Ein Glucose-6-phosphat-Dehydrogenase-Mangel (kurz: G6PD(H)-Mangel) führt zum Favismus bzw. zu einer Anämie. Diese Krankheit ist im Mittelmeerraum relativ weit verbreitet. Durch die defekte G6PD ist es den Erythrozyten nicht möglich, ihre Produktion von NADPH/H+ entsprechend des Bedarfs zu regulieren.
Das NADPH/H+ ist nötig, da die Erythrozyten durch die Sauerstoffaufnahme und ihren Stoffwechsel ständig unter oxidativem Stress stehen. Sie schützen ihre Zellmembran daher durch membranständiges Glutathion, das durch den Sauerstoff oxidiert wird. Um dieses jedoch kontinuierlich zu reduzieren, benötigt die Zelle NADPH/H+ als Reduktionsäquivalent. Ist die Regulation des Pentosephosphatwegs gestört, kann die Zelle bei hohem oxidativen Stress, wie z.B. einem Infekt, nicht ausreichend NADPH/H+ zur Verfügung stellen, wodurch die Zellmembran beschädigt wird. Auch die Einnahme bestimmter Medikamente, wie z.B. Aspirin in höheren Mengen ist dann kritisch.
Labordiagnostik
Klinische Chemie
Die Enzymaktivität von G6PD in Erythrozyten kann photometrisch bestimmt werden. Probenmaterial ist EDTA-Vollblut. Der Referenzbereich ist:
- 146 bis 376 U/1012 Erythrozyten
Die Referenzwerte sind methodenabhängig. Es gilt der vom ausführenden Labor abgegebene Wert.
Während einer hämolytischen Krise besteht der Erythrozytenpool hauptsächlich aus jungen Erythrozyten und Retikulozyten. Da in diesen die G6PD-Aktivität höher ist als in alten Erythrozyten, kann die Untersuchung dann falsch negativ sein. Daher sollte die Bestimmung im Intervall wiederholt werden.
Molekulardiagnostik
Eine molekulargenetische Untersuchung des G6PD-Gens ist ebenfalls möglich. Da viele verschiedene Mutationen vorliegen können, muss ggf. eine Sequenzierung vorgenommen werden.
Quellen
- OMIM - G6PD, abgerufen am 19.04.2022
- uniprot.org - G6PD, abgerufen am 19.04.2022