Avapritinib
Handelsname: Ayvakyt®
Englisch: avapritinib
Definition
Avapritinib ist ein Tyrosinkinasehemmer, der u.a. zur Therapie von gastrointestinalen Stromatumoren (GIST) und systemischer Mastozytose (ASM) eingesetzt wird.
Chemie
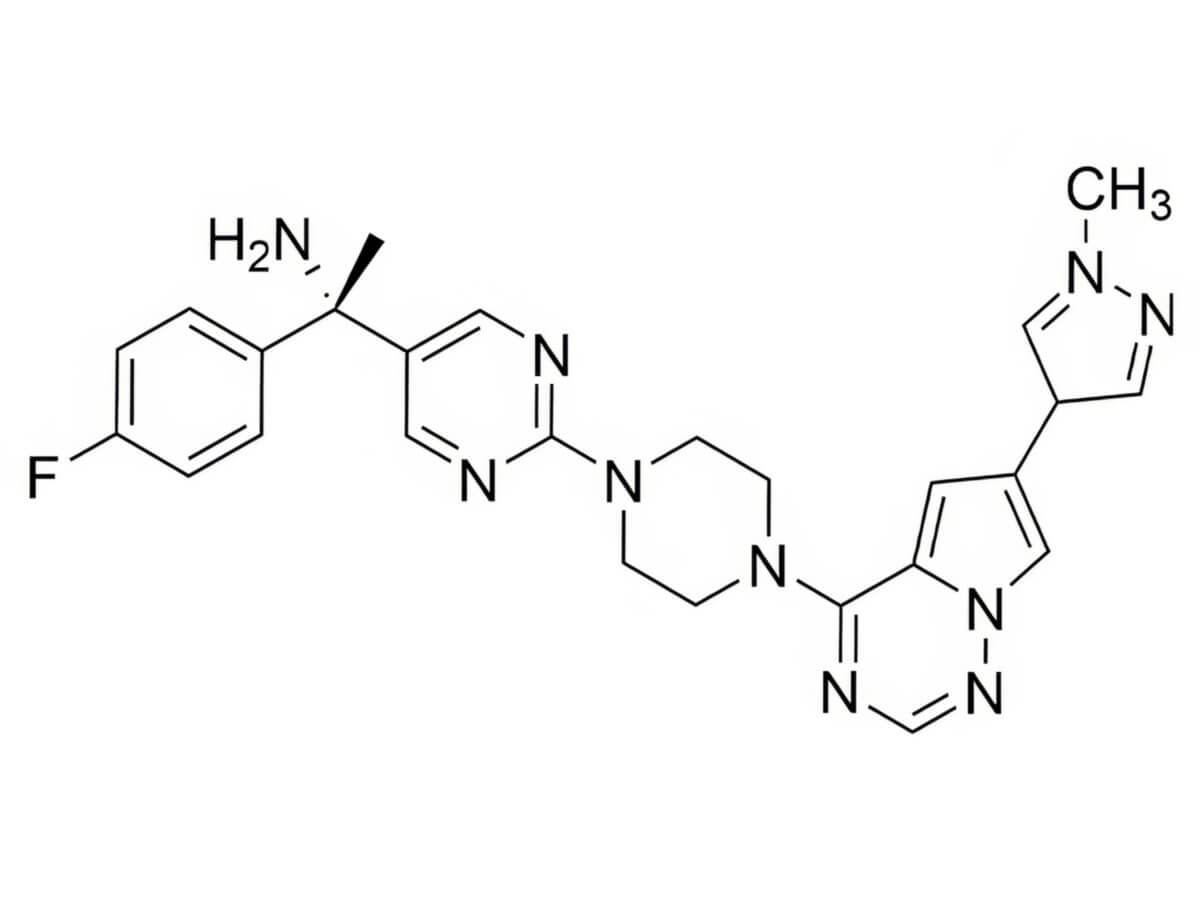
Avapritinib ist ein polyzyklischer Stickstoff-Heteroaromat mit der Summenformel C26H27FN10. Das Molekulargewicht beträgt 498,6 g/mol.[1]
Wirkmechanismus
Avapritinib ist ein Typ-1-Kinase-Inhibitor. Es wird bei einer D842V-Mutation im PDGFRA-Gen eingesetzt. Das Gen kodiert den Rezeptortyp α des Thrombozytenwachstumsfaktors (PDGF). Einerseits inhibiert Avapritinib spezifisch die mutierte PDGFRA-Kinase, andererseits hemmt es auch die mutierte KIT-Kinase.[2]
Pharmakokinetik
Etwa 2 bis 4 Stunden nach der Einnahme erreicht Avapritinib die maximale Plasmakonzentration. Die Bioverfügbarkeit steigt bei Einnahme einer fettreichen Mahlzeit.
Die Plasmaproteinbindung beträgt in vitro 98,8 %, das Verteilungsvolumen liegt bei 17 l/kg. Die Verstoffwechselung erfolgt über CYP3A4, CYP3A5 und zu geringem Anteil durch CYP2C9. Die Plasmahalbwertszeit des Avapritinib beträgt 32 bis 57 Stunden.
Indikation
Der Kinasehemmer Avapritinib wird bei einem inoperablen oder metastasierten GIST eingesetzt, wenn eine D842V-Mutation des Thrombozytenwachstumsfaktor-Rezeptor-alpha (PDGFRA) vorliegt.
Außerdem ist Avapritinib für die Behandlung der aggressiven systemischen Mastozytose (ASM), der systemischen Mastozytose mit assoziierter hämatologischer Neoplasie (SM-AHN) und der Mastzellleukämie (MCL) bei Erwachsenen zugelassen. Zuvor muss mindestens eine andere systemische Therapie angewendet worden sein.
Darreichungsform
- Tabletten mit einem Wirkstoffgehalt von 100, 200 oder 300 mg Avapritinib
Dosierung
Die Initialdosis beträgt 300 mg Avapritinib. Bei Anwendung mit einem CYP-Inhibitor kann die Dosis auf 100 mg verringert werden. Auch bei auftretenden Nebenwirkungen ist die Dosis zu reduzieren.[3]
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkungen
Die Nebenwirkungen von Avapritinib sind vielfältig und können unterschiedliche Organsysteme betreffen. Häufigst beobachtete Nebenwirkungen sind unter anderem:[3]
- Übelkeit (45%)
- Ermüdung (40%)
- Anämie (39%)
- periorbitale Ödem (33%)
- Gesichtsödeme (27%)
- Hyperbilirubinämie (28%)
- Durchfall (26%)
- Erbrechen (24%)
- periphere Ödeme (23%)
- vermehrte Tränensekretion (22%)
- Inappetenz (21%)
- Gedächtnisstörungen (20%)
Weitere, seltenere Nebenwirkungen einer Therapie mit Avapritinib können sein
- Tumorblutung
- Leukozytopenie, Neutropenie, Thrombozytopenie
- Elektrolytmangel, Nierenschädigungen, erhöhter Kreatininwert
- Verwirrtheit, Depression, Angst, Insomnie, Schwindel, Geschmacksänderungen,
- intrakranielle Blutungen, periphere Neuropathien, Somnolenz, Aphasie, Hypokinesie, Kopfschmerz, Gleichgewichtsstörungen
- okuläre Blutungen, Verschwommensehen, Bindehautblutung
- Hypertonie
- gastrointestinale Blutungen, Aszites, Verstopfung, Dysphagie
- Myalgie, Arthralgie, Rückenschmerzen, Asthenie, Fieber
- QT-Verlängerung
- Pleuraerguss
Wechselwirkungen
CYP3A4-Inhibitoren (z.B. Itraconazol) erhöhen den Plasmaspiegel von Avapritinib. Auch die gleichzeitige Gabe von CYP-Induktoren sollte vermieden werden, da es zu einer Wirkminderung kommen kann. Avapritinib ist selbst ebenfalls ein CYP3A4-Inhibitor und kann somit die Plasmaspiegel von CYP3A4-Substraten erhöhen.[3]
Zulassung
Die Zulassung in Deutschland erfolgte im November 2020. Eine Nutzenbewertung durch das IQWiG steht noch aus (Stand 2020).
Quellen
- ↑ Avapritinib in der pubchem-Datenbank, aufgerufen am 15.12.2020
- ↑ Neu: AYVAKYT bei gastrointestinalen Stromatumoren, Gelbe Liste online, aufgerufen am 15.12.2020
- ↑ 3,0 3,1 3,2 Fachinformation: AYVAKYT 100 mg Filmtablette, aufgerufen am 15.12.2020