Regulatorische T-Zelle
Synonyme: T-Suppressorzelle, Treg
Englisch: suppressor T cells, regulatory t cells
Definition
Die regulatorischen T-Zellen, kurz Treg-Zellen, sind eine spezialisierte Untergruppe der T-Lymphozyten (meist CD4+-T-Zellen), welche die Selbsttoleranz des Immunsystems regulieren. In der Immunphänotypisierung werden regulatorische T-Zellen durch die Expression des Transkriptionsfaktor FoxP3 identifiziert. Insgesamt machen die Treg-Zellen 5–10 % aller CD4+-T-Zellen im Kreislauf aus.
Geschichte
Die Existenz suppressiver T-Zellen wurde bereits in den 1970er-Jahren postuliert, jedoch wegen mangelnder Marker und methodischer Probleme verworfen. Erst Shimon Sakaguchi konnte 1995 eine T-Zell-Population mit regulatorischer Funktion identifizieren.
Parallel wurde bei Mäusen ein letales autoimmunes Syndrom entdeckt, verursacht durch eine Mutation im bislang unbekannten Gen FOXP3. Kurz darauf wurde gezeigt, dass FoxP3 als Masterregulator die Entwicklung und Funktion von Treg-Zellen steuert.
Diese Entdeckungen revolutionierten das Verständnis peripherer Immuntoleranz und wurden 2025 mit dem Nobelpreis für Physiologie oder Medizin ausgezeichnet.
Einteilung
Man unterscheidet in erster Linie natürliche Treg-Zellen (nTreg), die im Thymus gebildet werden, von induzierten Treg-Zellen (iTreg), die in der Peripherie aus naiven CD4+-T-Zellen entstehen. Nach dem Bildungsort werden diese auch als thymische (tTreg) oder periphere Treg-Zellen (pTreg) bezeichnet. In einigen Quellen werden noch weitere regulatorische T-Zellen genannt, die unten aufgeführt sind.
Natürliche Treg-Zellen
Die nTreg-Zellen sind meist selbstreaktiv, tragen CD4 sowie CD25 und exprimieren den L-Selektin-Rezeptor CD26L und CTLA-4. Die Proliferation der nTreg-Zellen wird durch IL-2 stimuliert. Sie sezernieren IL-4, IL-10 sowie TGF-β und können autoreaktive T-Zellen hemmen und so autoimmune Reaktionen unterdrücken.
Induzierte Treg-Zellen
Die Proliferation von iTreg-Zellen (auch TR1-Zellen genannt) wird in der Peripherie von dendritischen Zellen unter anderem über TGF-β, Retinsäuren, IL-10 und TNF-α stimuliert. Sie richten sich gegen Fremdantigene. Eine der Hauptfunktionen dieser regulatorischen T-Zellen besteht darin, Entzündungsreaktionen gegen Mikroorganismen der Darmflora zu hemmen. Dies gelingt durch die Sekretion von IL-10. Es wurde beobachtet, dass bei fehlendem IL-10 chronische Immunreaktionen gegen Antigene der Darmflora zu entzündlichen Darmerkrankungen führen. Weitere immunsuppressive Zytokine, die von den iTreg-Zellen sezerniert werden, sind IL-5, IFN-γ und TGF-β.
Weitere regulatorische T-Zellen
Es wurden regulatorische T-Zellen entdeckt, die statt CD4+ CD8+ sind und eine eingeschränkte Zytotoxizität aufweisen. Dabei handelt es sich meist um Gedächtniszellen, welche die tumorassoziierte T-Zell-Aktivierung der antigenpräsentierenden Zellen über IL-10 hemmen.
Sogenannte NK-T-Zellen tragen T-Zell-Rezeptoren, besitzen aber auch Oberflächenmarker von NK-Zellen. Diese Zellen können CD8- oder CD4-Rezeptoren tragen und agieren sowohl lytisch als auch regulatorisch.
Funktion
Die regulatorischen T-Zellen unterdrücken in bestimmten Situationen die Aktivierung des Immunsystems bzw. hemmen bei bereits erfolgter Immunantwort die Fortsetzung dieser Reaktion. So regulieren sie die Selbsttoleranz und senken das Risiko für die Entstehung von Autoimmunerkrankungen und Allergien. Weiterhin verhindern sie die Abstoßung eines Organs nach einer Transplantation und die Abstoßung des Fetus durch die Mutter.
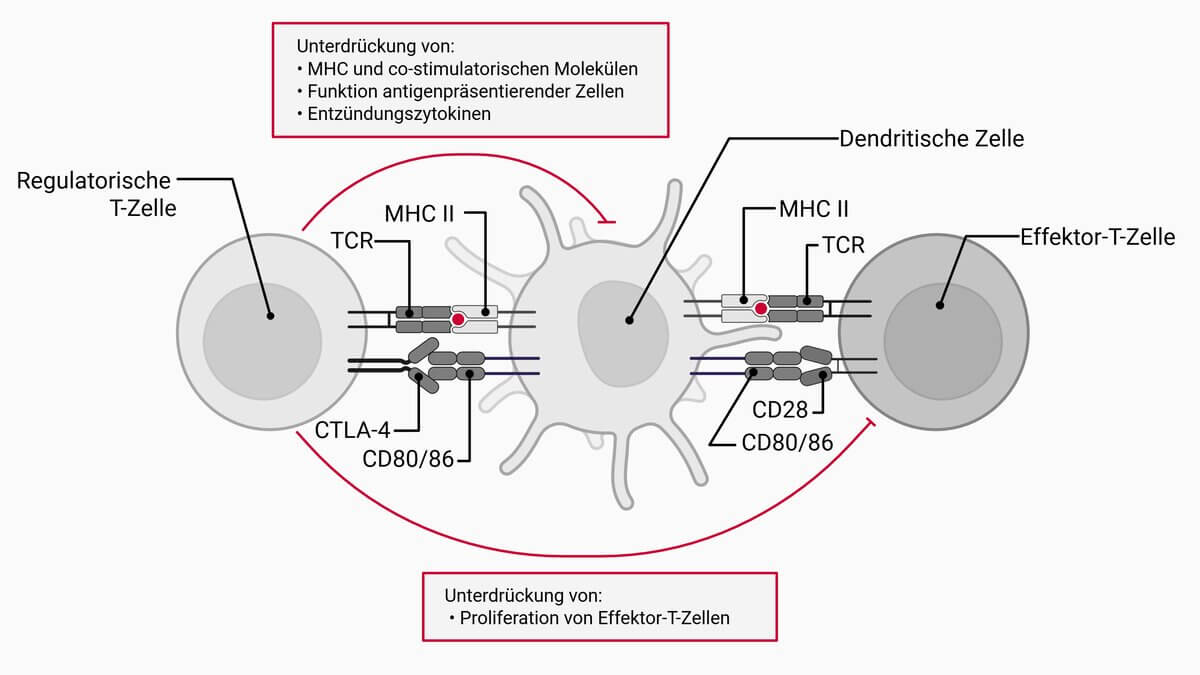
Die Aktivierung der Treg-Zellen erfolgt antigenspezifisch. Um die Immunreaktion zu hemmen, sezernieren sie verschiedene Zytokine, die unter anderem die Aktivierungsschwelle für naive T-Zellen hinaufsetzen. Eines dieser Zytokine ist Interleukin-10, das die proinflammatorische Funktion der antigenpräsentierenden Zellen hemmt, sodass die Reaktion der T-Effektorzellen herabgesetzt wird. Auch TGF-β wird von den Treg-Zellen sezerniert, was die Proliferation der T-Zellen hemmt.
Neben dieser zytokinvermittelten Suppression greifen Treg-Zellen auch über zellkontaktabhängige Mechanismen in die Immunantwort ein. Über die konstitutive Expression von CTLA-4 binden sie an die ko-stimulatorischen Moleküle CD80 und CD86 auf antigenpräsentierenden Zellen (z.B. dendritische Zellen) und blockieren so deren Aktivierungspotential.
Darüber hinaus exprimieren Tregs in hoher Dichte CD25, die α-Kette des IL-2-Rezeptors, und entziehen damit der Umgebung Interleukin-2. Dies führt zu einer reduzierten Verfügbarkeit des Wachstumsfaktors für andere T-Zellen und hemmt so deren Proliferation.
Klinik
Autoimmunität
Ein Mangel oder eine Funktionsstörung der Treg-Zellen steht im Zusammenhang mit Erkrankungen wie Typ-1-Diabetes, Multipler Sklerose und systemischem Lupus erythematodes. Mutationen im FOXP3-Gen führen beim Menschen zum IPEX-Syndrom – einer letalen Autoimmunerkrankung im Kindesalter.
Onkologie
Treg-Zellen infiltrieren Tumore und unterdrücken antitumorale Immunantworten. Therapeutisch wird an Strategien gearbeitet, die tumorumgebenden Treg-Zellen gezielt zu blockieren, z.B. über CCR8-Antikörper.
Transplantation
Treg-Zellen fördern die Transplantationstoleranz und werden in klinischen Studien zur Verlängerung der Organüberlebenszeit untersucht.
Literatur
- Murphy und Weaver, Janeway Immunologie, 9. Auflage, Springer Verlag, 2018
- Bröker et al., Grundwissen Immunologie, 4. Auflage, Springer Verlag, 2019
- Kaufmann, Basiswissen Immunologie, Springer Verlag, 2014
- nobelprize.org -Scientific background 2025 Immune tolerance - The identification of regulatory T cells and FOXP3, abgerufen am 07.11.2025
- Grover et al., Regulatory T Cells: Regulation of Identity and Function, Front Immunol, 2021
- Zhang et al., The progress and prospect of regulatory T cells in autoimmune diseases, J Autoimmun, 2020