Nukleozytoplasmatischer Transport
Englisch: nucleocytoplasmic transport
Definition
Der nukleozytoplasmatische Transport ist der aktive Membrantransport von RNA und Proteinen zwischen Zellkern und Zytoplasma. Dabei vermitteln verschiedene Transportrezeptoren wie Importine und Exportine die Translokation der Makromoleküle über die Kernporen.
Hintergrund
In eukaryotischen Zellen sind die DNA-Replikation und die Transkription räumlich von der Translation getrennt. Entsprechend müssen tausende von Makromolekülen zwischen Zellkern und Zytoplasma transferiert werden. Diese Transportprozesse finden in der Interphase statt. Dabei werden im Zellkern synthetisierte RNAs (mRNAs, tRNAs, miRNAs usw.) mit Hilfe von RNA-bindenden Proteinen und verschiedenen Transportrezeptoren exportiert. Gleichzeitig werden Proteine, die wichtige Funktionen im Zellkern erfüllen, mit Hilfe von Importinen in den Zellkern geschleust. Hierzu zählen u.a.:
Kernporen
Die Kernporen fungieren als "Tore" für den Zellkern. Während kleinere Moleküle durch Diffusion die Kernporen passieren, benötigen größere Moleküle die Unterstützung durch Transportrezeptoren.
Eine Kernpore besteht aus rund 500 Proteinen. Dabei handelt es sich um verschiedene Nukleoporine, die jeweils in mehrfacher Kopie vorliegen. Sie sind in drei ringförmigen Strukturen übereinander angeordnet.
Dem Inneren der Pore zugewandt befinden sich Nukleoporine, die zu den intrinsisch ungeordneten Proteinen zählen. Sie enthalten Cluster der Aminosäuren Phenylalanin (F) und Glycin (G). Diese "FG-Repeats" ragen in den Kanal hinein und bilden einen Filter, der die passive Diffusion großer Moleküle verhindert. Diese Moleküle werden stattdessen anhand von Signalsequenzen durch Transportrezeptoren erkannt und gebunden. Die Rezeptoren können ihre Beladung anschließend durch Interaktion mit den FG-Repeats durch die Kernpore schleusen.
Signalsequenzen
Der nukleozytoplasmatische Transport von Proteinen wird durch Signalsequenzen gesteuert. Es existieren Kernlokalisierungssignale (NLS), die zum Kernimport führen, und Kernexportsignale (NES), die den Kernexport initiieren. Sie werden jeweils durch spezifische Transportrezeptoren erkannt.
Transportrezeptoren
Zu den Transportrezeptoren zählen die Proteine der Karyopherin-Familie, die Importine, Exportine und Transportine umfassen. Die β-Karyopherine sind durch HEAT-Domänen gekennzeichnet, über die sie mit ihren Frachtmolekülen, den Nukleoporinen und dem kleinen G-Protein Ran gleichzeitig interagieren können.
Ein weiterer Transportrezeptor, der den Export von mRNAs vermittelt, ist das Protein NXF1.
Kernimport
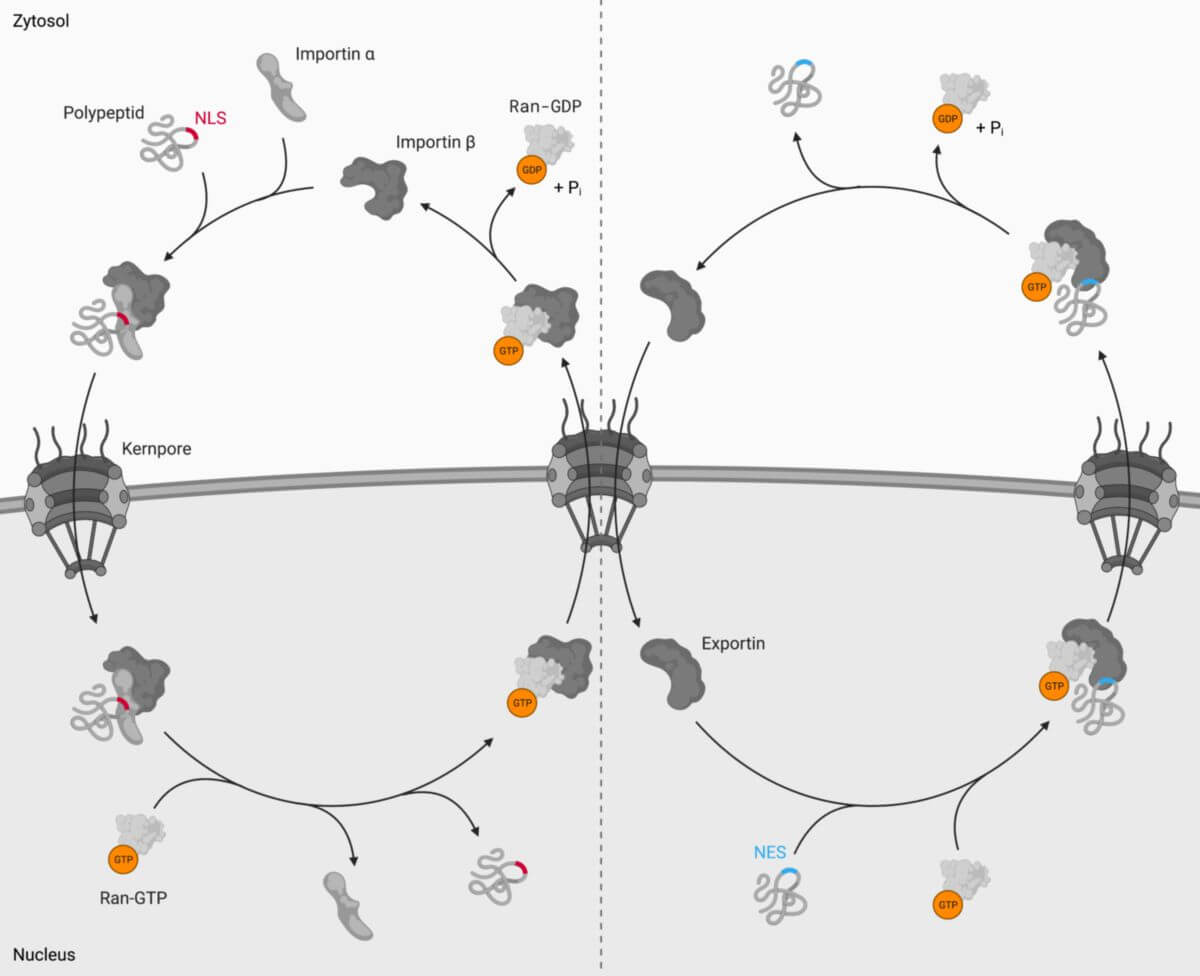
Importin-β-Proteine erkennen ihre Frachtproteine ("cargo") anhand des NLS und binden sie direkt oder mit Hilfe von Adapterproteinen (z.B. Importin-α oder Snurportin-1). Über die Interaktion mit Nukleoporinen wandern sie dann durch die Kernporen. Im Zellkern verdrängt die aktive GTP-gebundene Form von Ran das Frachtprotein (und gegebenenfalls des Adapterprotein) von Importin-β. Der Importin-β/Ran-GTP-Komplex wandert daraufhin zurück ins Zytoplasma, wo es zur GTP-Hydrolyse kommt und sich Ran-GDP daraufhin wieder von Importin-β ablöst. Importin-β steht nun für einen neuen Importvorgang bereit.
Kernexport
Beim Kernexport binden Exportine kooperativ das NES ihrer Frachtproteine und Ran-GTP. Dieser Komplex wird über die Wechselwirkung zwischen Nukleoporinen und den Exportinen durch die Kernpore geschleust. Angetrieben durch die GTP-Hydrolyse im Zytoplasma kommt es zu einer Konformationsänderung, die in der Freisetzung des Frachtproteins resultiert. Ran-GDP dissoziiert ebenfalls und das Exportin kehrt in den Zellkern zurück.
mRNA Export
Der Großteil der mRNA wird unabhängig von Karyopherinen und Ran transportiert. Der RNA-Kernexportfaktor NXF1 bindet als Dimer mit NXT1 an die mRNA. NXF1 verfügt sowohl über eine RNA-bindende Domäne (Leucine-rich-Repeat-Domäne) als auch über eine FG-Repeat-Bindungsstelle. Darüber kann es die Translokation durch die Kernporen vermitteln.
Ran GTP/GDP-Zyklus
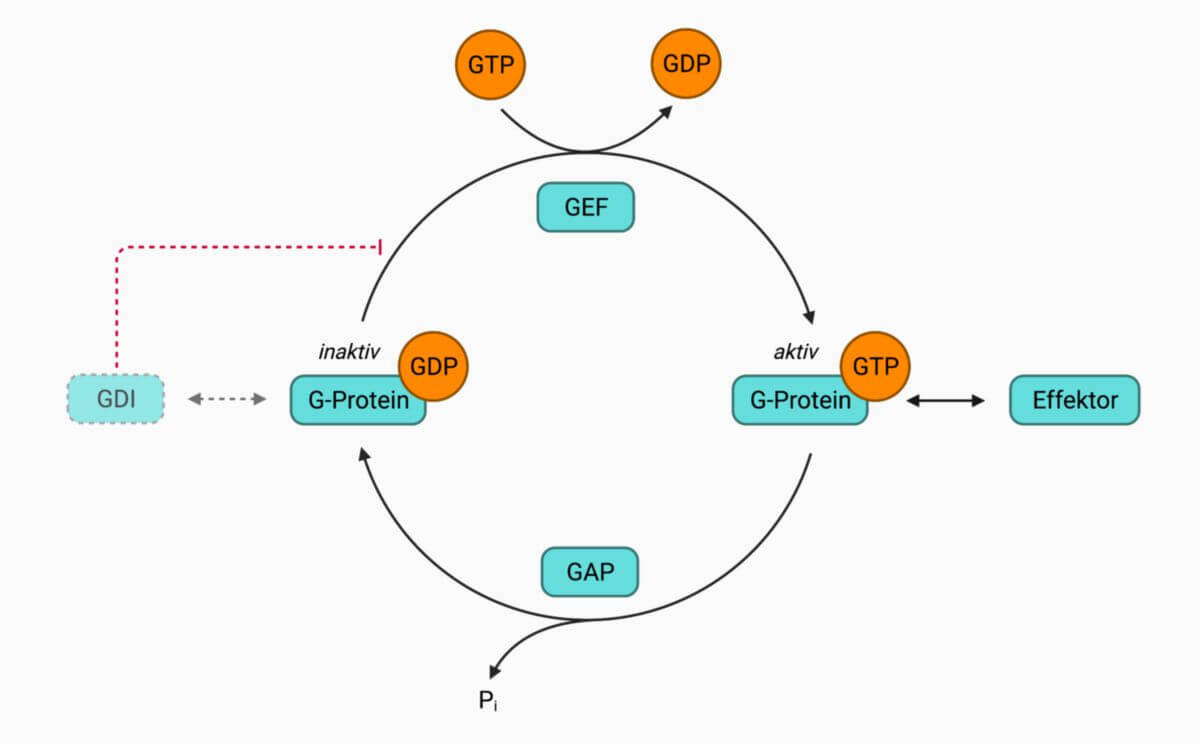
Der nukleozytoplasmatische Transport wird über den GTP/GDP-Zyklus der GTPase Ran angetrieben. Ran besitzt hohe Affinität für GTP und GDP. Da sowohl die GTP-Hydrolyse also auch der Nukleotidaustausch sehr langsame Prozesse sind, werden diese durch regulatorische Proteine unterstützt: die Guaninnukleotid-Austauschfaktoren (GEFs) und die GTPase-aktivierenden Proteine (GAPs).
Während die Ran-spezifischen GAPs (RanBP1 und RanBP2) sich im Zytoplasma befinden, ist der Ran-spezifische GEF (RCC1) durch Assoziation mit dem Chromatin ausschließlich im Zellkern lokalisiert. Dadurch ergibt sich ein Ran-GTP/Ran-GDP Gradient zwischen Zytoplasma und Zellkern, der die Be- und Entladung der Transportrezeptoren reguliert und durch die GTP-Hydrolyse Energie für den Transport bereitstellt.
Quellen
- Ding und Sepehrimanesh Nucleocytoplasmic Transport: Regulatory Mechanisms and the Implications in Neurodegeneration Int J Mol Sci 2021
- Cook et al. Structural biology of nucleocytoplasmic transport Annu Rev Biochem 2007