Importin
Synonym: Importrezeptor
Englisch: importin, import receptor
Definition
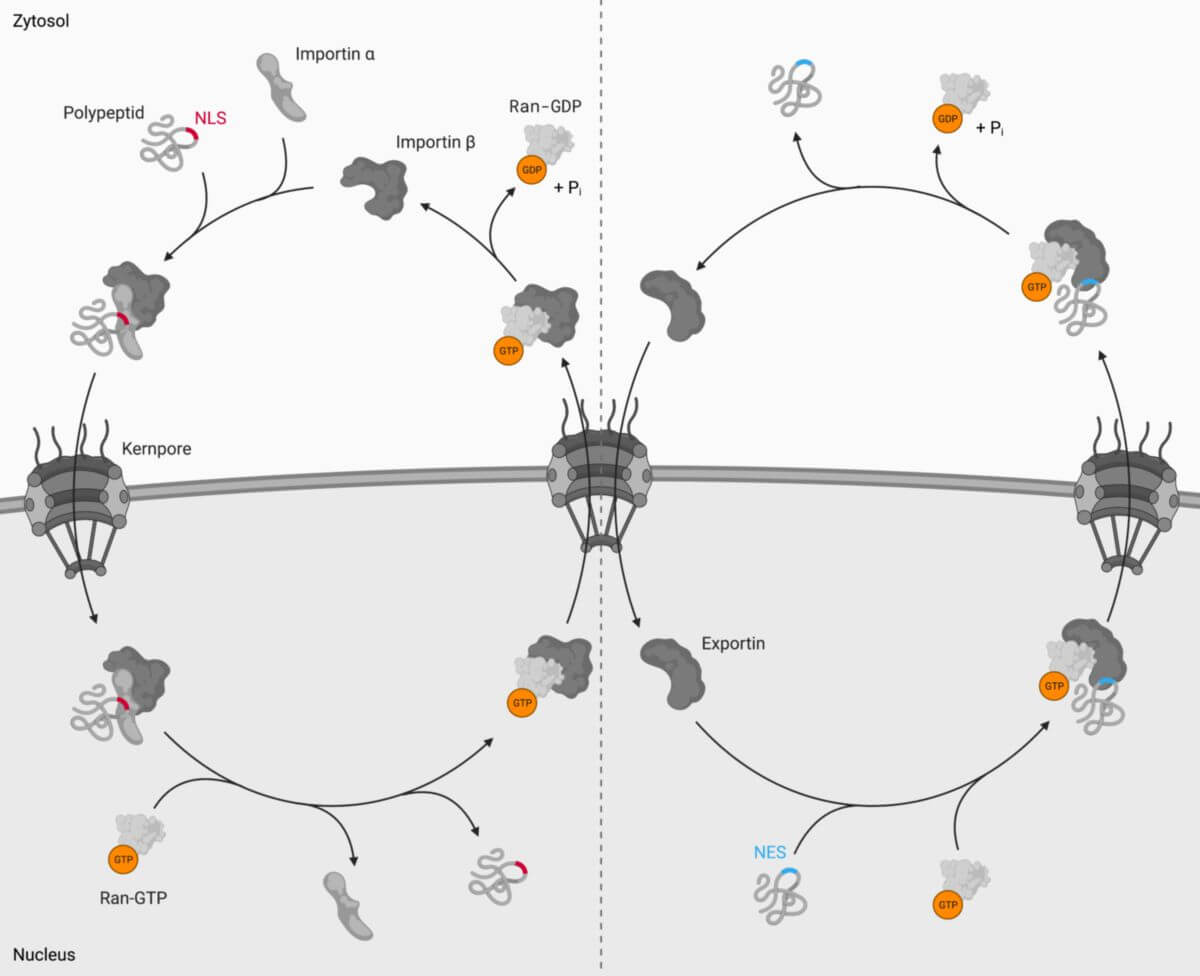
Importine erkennen Kernlokalisierungssignale (NLS) an Proteinen und transportieren diese vom Zytoplasma in den Zellkern. Sie zählen zur Gruppe der Karyopherine.
siehe auch: Exportin
Cargo
Zu den transportierten Molekülen ("cargo") zählen verschiedene Proteine, die wichtige Aufgaben im Zellkern erfüllen:
Einteilung
Importine werden in zwei Unterfamilien eingeteilt: Importin-α (bzw. Karyopherin-α) und Importin-β (bzw. Karyopherin-β).
Importin-α
Basismechanismus
Importin-α fungiert als Adapterprotein. Es bindet zunächst an das NLS seines Frachtproteins und rekrutiert daraufhin Importin-β1. Importin-β1 schleust nachfolgend den gesamten Komplex durch die Kernporen, indem es mit den Nukleoporinen interagiert. Im Zellkern verdrängt Ran-GTP Importin-α von Importin-β1 und das Frachtprotein wird freigesetzt. Importin-α wird danach durch Exportin-2 wieder zurück ins Zytoplasma transportiert und steht für einen weiteren Importvorgang zur Verfügung.
Genetik
Es existieren sieben humane Importin-α-Isoformen:
| Protein | Gen | Genlokus |
|---|---|---|
| Importin-α1 | KPNA2 | 17q24.2 |
| Importin-α3 | KPNA4 | 3q25.33 |
| Importin-α4 | KPNA3 | 13q14.2 |
| Importin-α5 | KPNA1 | 3q21.1 |
| Importin-α6 | KPNA5 | 6q22.1 |
| Importin-α7 | KPNA6 | 1p35.2 |
| Importin-α8 | KPNA7 | 7q22.1 |
Die Isoformen weisen unterschiedliche Expressionsmuster und subzelluläre Lokalisationen auf.
Struktur
Importin-α weist drei konservierte Strukturelemente auf:
- eine N-terminale Importin-β-bindende Domäne (IBB-Domäne)
- eine NLS-Bindungsstelle, bestehend aus 10 Armadillo-Repeats
- eine C-terminale Aminosäuresequenz, die aus sauren Aminosäuren besteht und als Erkennungssignal für Exportin-2 dient
Weitere Funktionen
Importin-α hat neben dem nukleären Import weitere Funktionen. Hierzu zählen unter anderem die Ausbildung des Spindelapparats, die Polymerisation von Laminen und die Bildung der Kernhülle.
Importin β
Importin-β-Proteine können als Heterodimere mit Apapterproteinen aber auch als Monomere fungieren.
Adapterproteine
Importin-β benötigt für die Bindung bestimmter Frachtproteine zusätzliche Adapterproteine. Wie bereits zuvor beschrieben, fungiert Importin-α als Adapterprotein bei der Erkennung klassischer NLS (cNLS). Ein weiteres Adapterprotein ist das Snurportin-1, das eine RNA-Modifikation von snRNPs (small nuclear ribonucleoproteins) erkennt und bindet. Diese Ribonukleoproteine werden für das Splicing im Zellkern benötigt.
Genetik
In der folgenden Tabelle sind die humanen Vertreter der Importin-β-Unterfamilie aufgelistet:
| Protein | Gen | Genlokus |
|---|---|---|
| Importin β1 | KPNB1 | 17q21.32 |
| Importin-4 | IPO4 | 14q12 |
| Importin-5 | IPO5 | 13q32.2 |
| Importin-7 | IPO7 | 11p15.4 |
| Importin-8 | IPO8 | 12p11.21 |
| Importin-9 | IPO9 | 1q32.1 |
| Importin-11 | IPO11 | 5q12.1 |
| Importin-13 | IPO13 | 1p34.1 |
| Transportin-1 | TNPO1 | 5q13.2 |
| Transportin-2 | TNPO2 | 19p13.13 |
| Ran-bindendes-Protein 6 | RANBP6 | 9p24.1 |
Struktur
Die kennzeichnende Struktur der Importin-β-Unterfamilie ist die HEAT-Repeat-Domäne, die meist aus rund 20 HEAT-Repeats besteht. Ein HEAT-Repeat umfasst zwei antiparallele α-Helices, die durch eine kurze Schleife ("loop") getrennt sind. Die Helices können in Stapeln angeordnet werden und verleihen dem Protein eine hohe strukturelle Flexibilität und die Fähigkeit zur Interaktion mit verschiedensten Bindungspartnern.
Klinik
Importinen wird eine Rolle bei Krebserkrankungen zugeschrieben. So dient Importin-α1 als Biomarker für verschiedene Krebsformen. Erhöhte Level gehen mit einer schlechten Prognose einher.[1] Importin-α8 begünstigt die Tumorprogression bei Pankreaskarzinomen.[2]
Importine spielen zudem eine wichtige Rolle bei Virusinfektionen. So sind u.a. Importin-α3 und Importin-7 entscheidend für den nukleären Import von Proteinen des HI-Virus, wodurch die reverse Transkription und Integration der viralen RNA ins Genom der Wirtszelle ermöglicht werden.
Quellen
- ↑ Christiansen und Dyrskjøt The functional role of the novel biomarker karyopherin α 2 (KPNA2) in cancer Cancer Lett 2013
- ↑ Laurila et al. KPNA7, a nuclear transport receptor, promotes malignant properties of pancreatic cancer cells in vitro Exp Cell Res 2014
Literatur
- Ding und Sepehrimanesh Nucleocytoplasmic Transport: Regulatory Mechanisms and the Implications in Neurodegeneration Int J Mol Sci 2021
- Miyamoto et al. Importin α: a key molecule in nuclear transport and non-transport functions J Biochem 2016