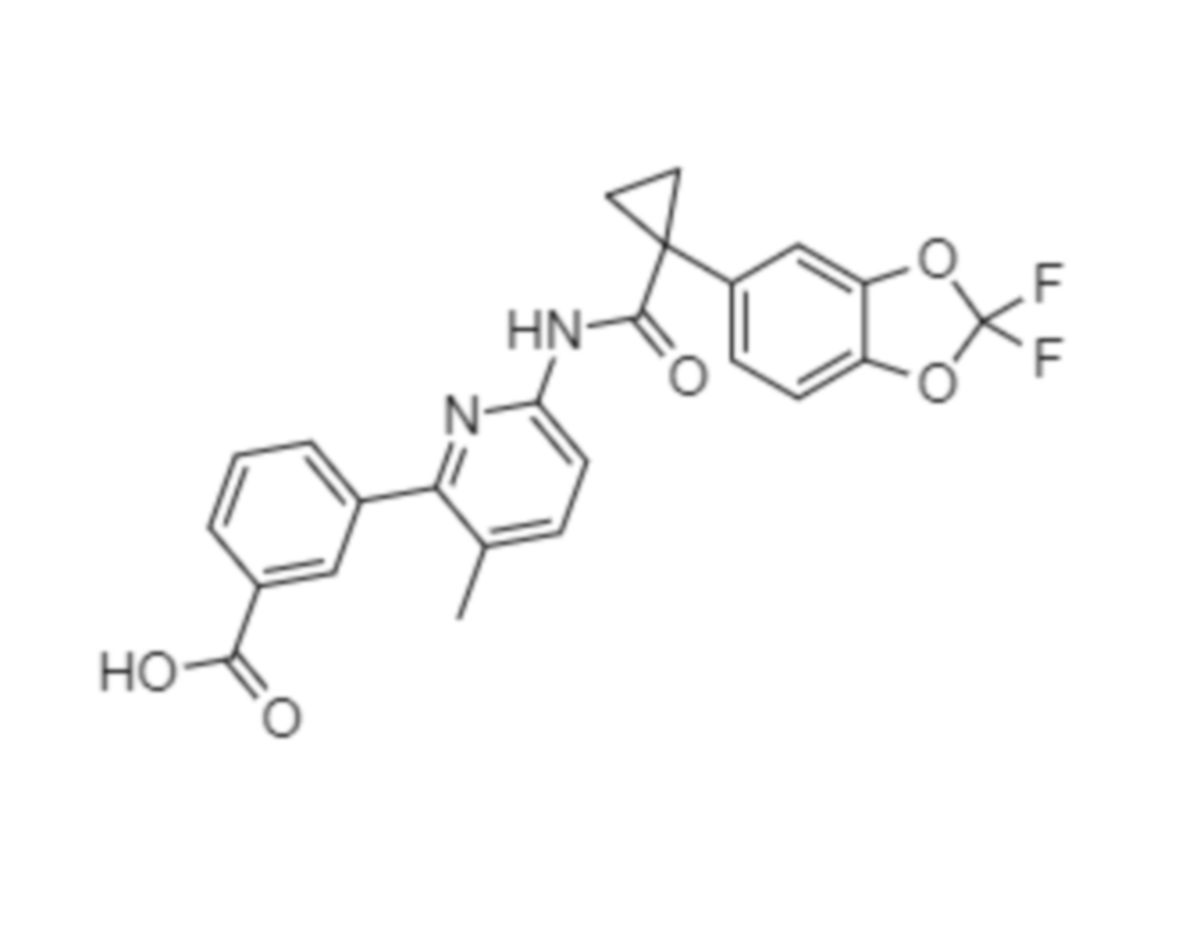
Lumacaftor
Handelsname: Orkambi®
Englisch: lumacaftor
Definition
Lumacaftor ist ein Arzneistoff aus der Gruppe der CFTR-Korrektoren, der zur Behandlung der zystischen Fibrose mit F508del-Mutation im CFTR-Gen zugelassen ist. Diese Mutation ist mit 66% die am häufigsten auftretende Form der Mukoviszidose.
Chemie
Bei Raumtemperatur liegt Lumacaftor als farbloses Pulver vor, das praktisch unlöslich in Wasser ist. Der Wirkstoff besitzt eine molare Masse von 452,4 g/mol. Die Summenformel lautet C24H18F2N2O5.
Wirkmechanismus
Die zystische Fibrose beruht auf verschiedenen Mutationen des CFTR-Gens, aus denen ein Defekt bzw. Mangel des Cystic Fibrosis Transmembrane Conductance Regulator (CFTR) resultiert. Bei diesem Protein handelt es sich um einen cAMP-gesteuerten Chloridkanal, der vornehmlich auf Zelloberflächen vorkommt. Zu seinen Hauptaufgaben zählt die Regulation des Wasser- und Elektrolyttransports in der Plasmamembran. Bei einer F508del-Mutation werden drei Nukleotide fälschlich deletiert, was dazu führt, dass an Stelle 508 des Proteins die Aminosäure Phenylalanin fehlt. Hieraus resultiert eine fehlerhafte Proteinfaltung, was wiederum zu einem Abbau des Proteins im Proteasom führt. Somit wird die Menge des CFTR-Proteins auf der Zelloberfläche bei dieser Mutation stark verringert. Weiterhin zeigt sich eine geringere Öffnungswahrscheinlichkeit des Kanals, sodass die wenigen vorhandenen Proteine nicht effektiv arbeiten.
Lumacaftor wirkt als CFTR-Korrektor direkt auf die zelluläre Verarbeitung von F5080del-CFTR. Dabei fungiert der Arzneistoff als Chaperon und trägt zur korrekten Faltung des Proteins bei. Durch die Kombination mit Ivacaftor wird darüber hinaus eine vermehrte Expression des CFTR-Kanals herbeigeführt.
Indikation
Bislang ist Lumacaftor lediglich in Kombination mit Ivacaftor zur Behandlung der zystischen Fibrose bei Patienten ab sechs Jahren zugelassen, die eine homozygote F508del-Mutation aufweisen. Bei heterozygoter F508del-Mutation mit einer anderen Mutation auf dem zweiten Allel zeigte sich keine Wirksamkeit des Arzneimittels.
Darreichungsformen
Die Fixkombination mit dem seit 2012 auf dem Markt befindlichen CFTR-Potentiator Ivacaftor wird in Form von Filmtabletten als Orkambi® 200 mg/125 mg in Packungseinheiten zu je 28 Tabletten von der Firma Vertex Pharmaceuticals vertrieben. Ende 2015 erlangte das Arzneimittel Orphan-drug-Status und konnte somit ein beschleunigtes Zulassungsverfahren durchlaufen.
Dosierung
Die Tabletten werden in zwölfstündigen Abständen (morgens und abends) zu einer fettreichen Mahlzeit eingenommen.
Nebenwirkungen
Zu den häufigsten beobachteten Nebenwirkungen gehören:
Schwerwiegendere Nebenwirkungen, die bei mehr als 0,5% der Patienten auftraten, sind:
Wechselwirkungen
Da Lumacaftor ein starker CYP3A4-Induktor und Ivacaftor ein schwacher CYP3A4-Inhibitor ist, muss auf entsprechende Wechselwirkungen geachtet werden. So käme es bei gleichzeitiger Behandlung mit starken CYP3A4-Inhibitoren zu einer stark erhöhten Ivacaftor-Exposition, wohingegen der Wirkspiegel von Lumacaftor nicht beeinflusst würde. Als Beispiel ist hier vor allem Itraconazol zu nennen.
Im Umkehrschluss ist ebenfalls die zeitgleiche Anwendung starker CYP3A4-Induktoren, wie Rifampicin oder Phenobarbital nicht zu empfehlen. Hier käme es zu unwirksamen Plasmaspiegeln der entsprechenden Induktoren sowie des Ivacaftors. Bei schwachen und mäßig starken CYP3A4-Induktoren und Inhibitoren ist keine Dosisanpassung vonnöten.
Kontraindikationen
- Heterozygote F508del-Mutation mit einem zweiten mutierten Allel, dessen Mutation] voraussichtlich zu einer fehlenden CFTR-Produktion führt oder in vitro nicht auf Ivacaftor anspricht
- Gating-Mutation im CFTR-Gen, da das Arzneimittel hier nicht getestet wurde
- Überempfindlichkeit gegen den Wirkstoff oder einen der weiteren Bestandteile
Verordnungshinweis
Orkambi® sollte nur von Ärzten verordnet werden, die erfahren in der Behandlung der Mukoviszidose sind. Weiterhin sollten es Schwangere vorsichtshalber nur in Ausnahmefällen erhalten. Stillen unter der Anwendung des Arzneimittels ist kritisch zu hinterfragen.
Kosten
Die Jahrestherapiekosten von Lumacaftor liegen pro Patient bei rund 195.000 Euro. Die Anzahl der GKV-Patienten, die für eine Lumacaftor-Therapie in Frage kommen, liegt in Deutschland bei rund 2.500 Individuen.[1] Daraus ergeben sich bei einer medikamentösen Vollversorgung rechnerisch Kosten von etwa 500 Mio. Euro pro Jahr zu Lasten der GKV.
Quellen
- ↑ Lumacaftor / Ivacaftor – Bewertung gemäß § 35a Abs. 1 Satz 10 SGB V IQWiG-Berichte – Nr. 372
- Milla, CE et al. (2017). Lumacaftor/Ivacaftor in Patients Aged 6-11 Years with Cystic Fibrosis and Homozygous for F508del-CFTR. AJRCCM, 195(7), 912-920.
- Wainwright, CE et al. (2015). Lumacaftor-Ivacaftor in Patients Homozygous for Phe508del CFTR. N Engl J Med, 373(3), 220-231.
- Mayer, M. (2016). Lumacaftor-ivacaftor (Orkambi) for cystic fibrosis: behind the ‘breakthrough’. Evidence-Based Medicine, 21(3), 83-86.
- European Medicines Agency, Zulassung von Orkambi letzter Zugriff am 28. November 2017.
- European Medicines Agency, Nachtrag zur Indikation letzter Zugriff am 28. November 2017.
- PharmaWiki Lumacaftor letzter Zugriff am 28. November 2017.