Interleukin-1β
Synonym: IL-1β
Definition
Interleukin-1β ist ein Zytokin aus der Familie der Interleukine. Es zählt zu den proinflammatorischen Zytokinen und spielt als zweite Untereinheit (neben Interleukin-1α) eine wichtige Rolle bei der Vermittlung der Entzündungsreaktion durch Interleukin-1.
Genetik
IL-1β wird auf dem Chromosomenabschnitt 2q14 mit 810 Basenpaaren kodiert und zunächst als ein inaktives IL-1β-Vorläuferprotein (Procaspase 1) mit 266 Aminosäuren und einer Molekülmasse von 30,75 kDa transkribiert. Seine Synthese wird durch Toll-like Rezeptor-Agonisten stimuliert.
Bildung
Hauptproduzenten von IL-1β sind im Blut zirkulierende Monozyten, Makrophagen sowie dendritische Zellen. Voraussetzung für die Bildung von IL-1β ist die Aktivierung des Inflammasoms. Darunter versteht man einen intrazellulären Proteinkomplex, der durch zelluläre Gefahrensignale (DAMPs) oder mikrobielle Produkte (PAMPs) aktiviert wird. Beispielhaft sie hier die Stimulation des P2X7-Rezeptors durch extrazelluläre Nukleotide (z.B. ATP) genannt. Dabei kommt es zu einem Efflux von Kaliumionen aus der Zelle, gefolgt von einem Influx von Calciumionen.
Das Inflammasom rekrutiert und aktiviert die Procaspase 1, die dann unter Einfluss calciumabhängiger Phospholipasen zur aktiven Caspase 1 ( IL-1β-Convertase) gespalten wird. Letztere konvertiert das reife, aktive IL-1β aus seiner inaktiven Vorstufe im Zytosol.
Signalwege
Nach der Fusion von IL-1β mit Interleukin-1α (IL-1α) zum Interleukin-1 kann das Zytokin an folgenden zwei Rezeptoren seine Wirkung entfalten:
Interleukin-1-Rezeptor Typ 1
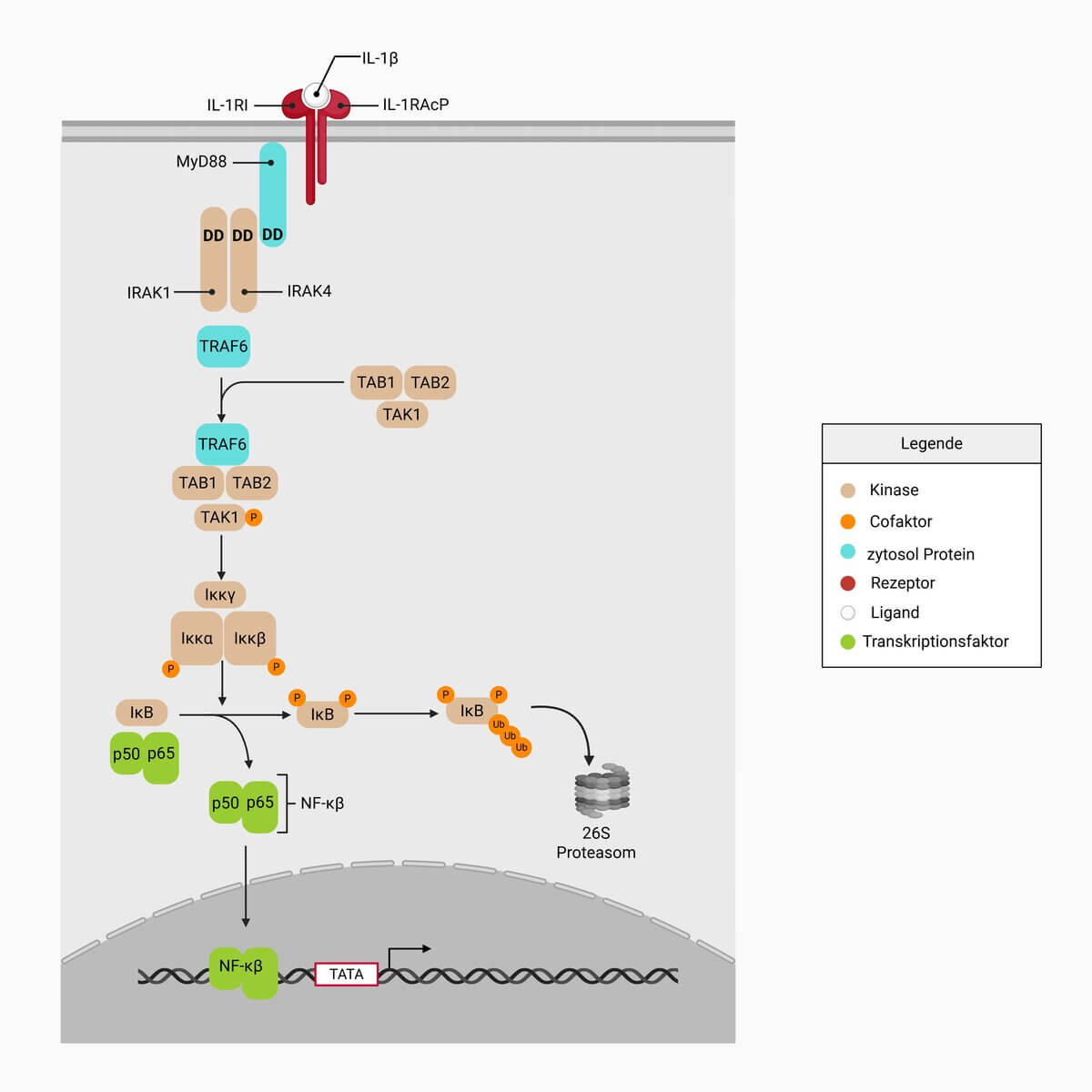
Interleukin-1β signalisiert über einen Rezeptorkomplex, der aus dem Interleukin-1-Rezeptor 1 (IL-1R1) und dem Interleukin-1 receptor accessory protein (IL-1RAcP) besteht. Der IL-1R1 kommt ubiquitär auf allen Zellen vor und wird in seiner Expression kaum reguliert. Nach Bindung von IL-1β und Oligomerisierung des Rezeptors wird zunächst das Adapterprotein MyD88 über seine TIR-Domäne an den Rezeptorkomplex rekrutiert. MyD88 besitzt zusätzlich eine Death-Domäne (DD), welche die Anlagerung der IL-1-Rezeptor-assoziierten Kinasen (IRAK1 und IRAK4) ermöglicht.
Durch die Phosphorylierung von IRAK1 wird TRAF6 aktiviert, das nach Ubiquitinierung vom Rezeptorkomplex dissoziiert und an einen weiteren Komplex bindet, bestehend aus der Kinase TAK1 sowie den TAK-bindenden Proteinen TAB1 und TAB2. Die Aktivierung von TAK1 führt zur Stimulation des IKK-Komplexes (bestehend aus IKKα, IKKβ und IKKγ).
Der IKK-Komplex phosphoryliert den Inhibitor IκB, der normalerweise NF-κB im Zytoplasma inaktiv hält. Nach Ubiquitinierung und proteasomalem Abbau von IκB wird NF-κB (meist als p50/p65-Heterodimer) freigesetzt und in den Zellkern transloziert. Dort bindet NF-κB an Enhancer-Elemente proinflammatorischer Zielgene und induziert die Expression von Chemokinen (z.B. IL-8, RANTES), proinflammatorischen Zytokinen (z.B. IL-6, TNF, IL-1 selbst) sowie entzündungsfördernden Enzymen (z.B. Phospholipase A2, COX2). Dadurch werden Prostaglandine, Eicosanoide und weitere Mediatoren der Entzündungsreaktion gebildet.
Interleukin-1-Rezeptor Typ 2
Die Bindung an den IL-1R2 führt hingegen zu keinerlei Stimulation der Ziele, das IL-1 wird somit antagonisiert, die inflammatorische Wirkung abgeschwächt.
Biologische Wirkung
IL-1β wird im Rahmen einer inflammatorischen Antwort sezerniert und ist in wichtige Vorgänge wie die Zellproliferation, Zelldifferenzierung sowie die Apoptose involviert. Zu den wichtigsten Funktionen gehören:
- Induktion von Fieber (bereits wenige Nanogramm)
- Induktion von Akute-Phase-Proteinen
- Rekrutierung von Neutrophilen Granulozyten
- Rekrutierung von Thrombozyten
Weiterhin induziert es die Produktion der Cyclooxygenase 2 (auch COX2 oder Prostaglandin-Endoperoxid-Synthase 2, PGES2) im zentralen Nervensystem, wodurch es zur neuronalen Vermittlung von Schmerzen, Hypersensibilität sowie zur Entstehung von Hyperalgesie mit beiträgt.
Quelle
- Heinrich et al. Löffler/Petrides Biochemie und Pathobiochemie. 9. Auflage. Springer Verlag