Glutamatrezeptor
Englisch: glutamate receptor
Definition
Glutamatrezeptoren sind Transmembranrezeptoren, deren Ligand der Neurotransmitter Glutamat ist.
Funktion
Glutamatrezeptoren kommen vornehmlich in der Zellmembran von Neuronen und Gliazellen vor, werde aber auch außerhalb des ZNS exprimiert. Sie sind u.a. essenziell für neuronale Kommunikation, Erinnerungsvermögen und Lernen und bilden ein wichtigen Bestandteil der synaptischen Plastizität.
Eine Überaktivierung der Glutamatrezeptoren kann Exzitotoxizität auslösen, die bei vielen neurodegenerativen Erkrankungen eine Rolle spielt.
Klassifikation
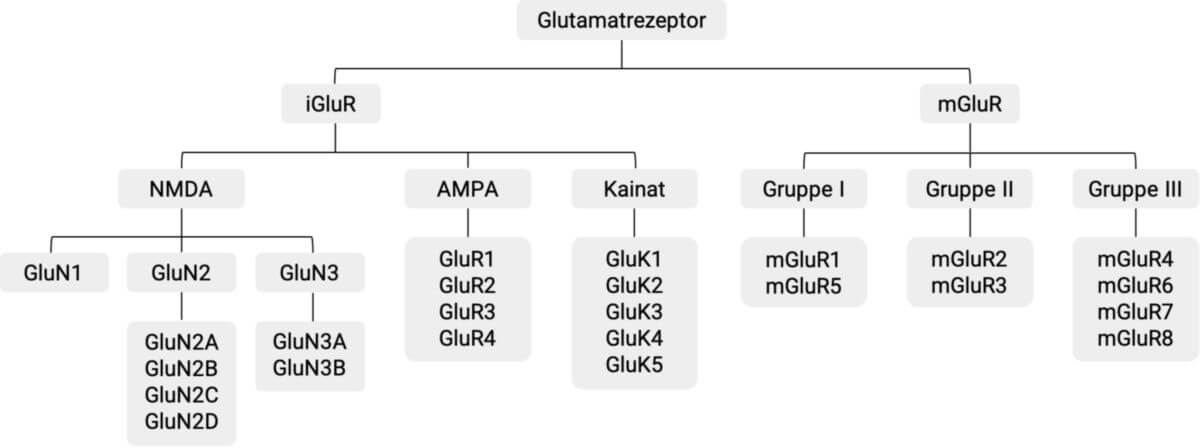
Man unterscheidet zunächst systematisch in ionotrope (iGluR) und metabotrope Glutamatrezeptoren (mGluR). Weitere Unterteilungen innerhalb der beiden Gruppen basieren auf den pharmakologischen Eigenschaften der Rezeptoren.
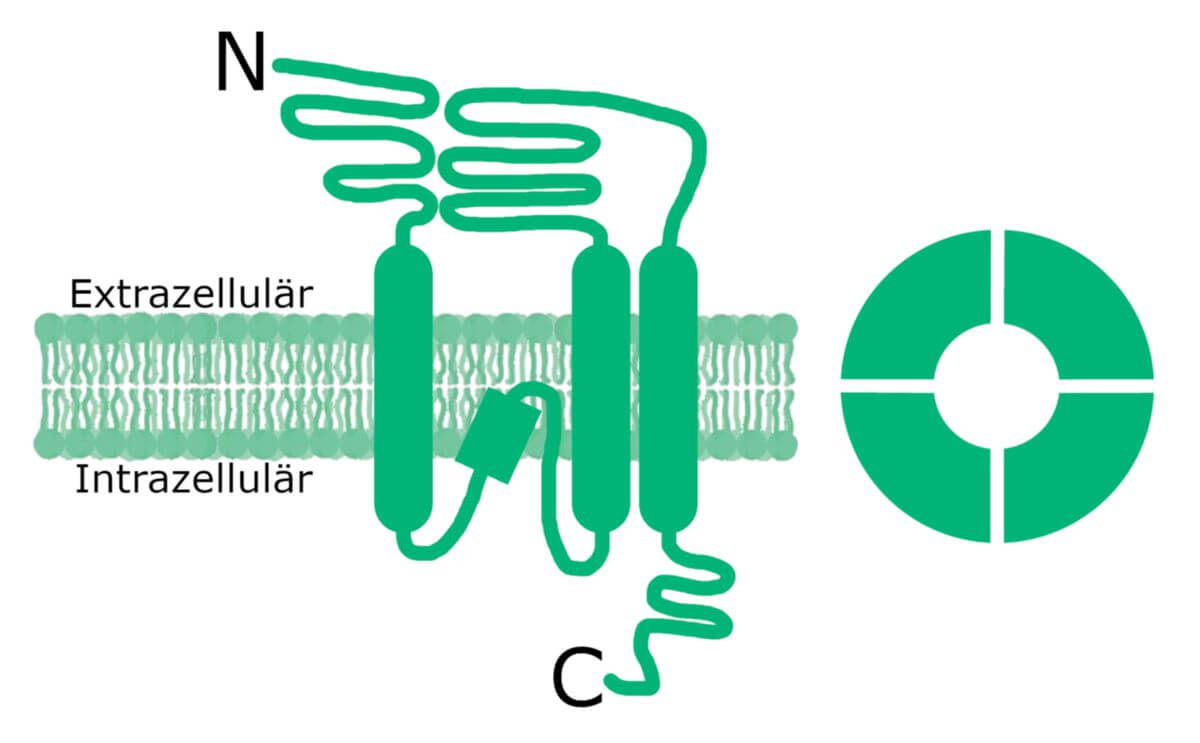
Ionotrope Glutamatrezeptoren
Ionotrope Glutamatrezeptoren sind ligandengesteuerte Ionenkanäle, die nach Aktivierung durchlässig für Kationen werden. In der Gruppe der ionotropen Glutamatrezeptoren unterscheidet man drei Typen, die sich hinsichtlich ihres Aufbaus sowie der Bindungs-, Aktivierungs- und Leistungseigenschaften unterscheiden. Ihre Benennung leitet sich von der Präferenz für verschiedene Glutamatrezeptor-Agonisten ab.
Aufbau
AMPA-Rezeptoren
AMPA-Rezeptoren sind tetramere Ionenkanäle. Je nach Aufbau sind sie permeabel für Na+ oder Ca2+-Ionen. Die Kanäle sind nach ihrem Agonisten benannt, der α-Amino-3-hydroxy-5-methylisoxazol-4-propionsäure (AMPA).
NMDA-Rezeptoren
NMDA-Rezeptoren sind tetramere, nicht-selektive Kationenkanäle. Sie sind liganden- und spannungsabhängig. Ein Agonist ist das N-Methyl-D-Aspartat (NMDA).
Kainat-Rezeptoren
Kainat-Rezeptoren sind tetramere Ionenkanäle, die für Na+-, K+ und zum Teil auch für Ca2+-Ionen leitfähig sind. Sie werden nach ihrem Agonisten, der Kaininsäure (Kaina) benannt.
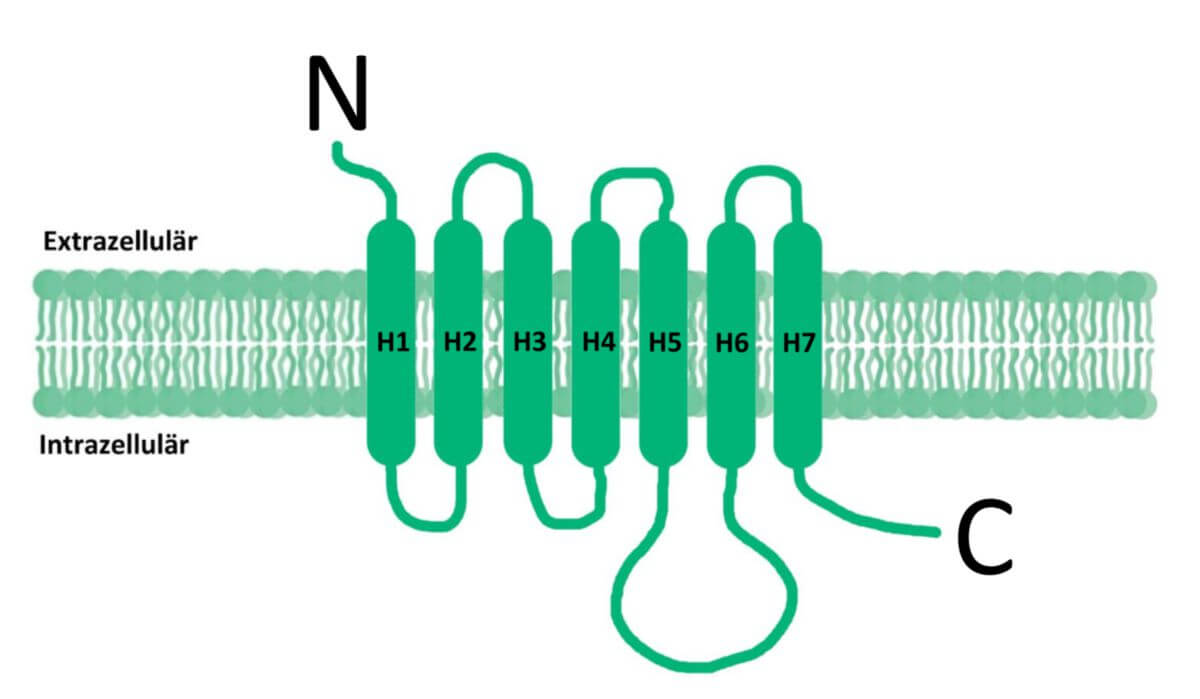
Metabotrope Glutamatrezeptoren
Bei den metabotropen Glutamatrezeptoren handelt es sich nicht um Ionenkanäle, sondern um G-Protein-gekoppelte Rezeptoren. Sie modulieren mittels Signaltransduktion die Aktivität anderer Proteine (z.B. verschiedener Ionenkanäle). Es gibt acht humane mGluR Vertreter, die aufgrund ihrer Eigenschaften in drei Gruppen eingeteilt werden.
| Gruppe | Rezeptoren | Lokalisation | G-Protein | Wirkmechanismus |
|---|---|---|---|---|
| I | meist postsynaptisch | Gq | Aktivierung der Phospholipase | |
| II | meist präsynaptisch | Gi/o | Inhibition der Adenylatzyklase | |
| III | meist präsynaptisch | Gi/o | Inhibition Adenylatzyklase |
Aufbau
Gruppe I (Gq-gekoppelt)
Zur Gruppe I zählen die Rezeptoren mGluR1 und mGluR5. Sie kommen meist an der Postsynapse vor und sind an Gq-Proteine gekoppelt. Über diese aktivieren sie die Phospholipase C, die nachfolgend die Hydrolyse von Phosphatidylinositol-4,5-bisphosphat (PIP2) zu Inositoltriphosphat (IP3) und Diacylglycerol (DAG) katalysiert. IP3 aktiviert den IP3-Rezeptor, was zu einer Freisetzung von Ca2+ aus dem endoplasmatischen Retikulum führt, während DAG als Cofaktor für die Proteinkinase C fungiert.
mGluR der Gruppe I werden durch den Agonist Dihydroxyphenylglycin (DHPG) aktiviert.
Gruppe II (Gi-gekoppelt)
Zur Gruppe II zählen die Rezeptoren mGluR2 und mGluR3. Ihre Aktivierung führt zu einer Inhibition der Adenylatzyklase und einer daraus resultierenden Hemmung der cAMP-Synthese und cAMP-abhängiger Signalwege.
mGluR der Gruppe II werden durch die Agonisten Eglumegad (LY354740), Biphenylindanon A und DCG-IV aktiviert.
Gruppe III (Gi-gekoppelt)
Zur Gruppe III zählen die Rezeptoren mGluR4, mGluR6, mGluR7 und mGluR8. Ihre Aktivierung führt ebenfalls zu einer Inhibition der Adenylatzyklase und einer daraus resultierenden Hemmung cAMP-abhängiger Signalwege.[1]
mGluR der Gruppe III werden durch den Agonist 2-Amino-4-Phosphonobuttersäure (L-AP4) aktiviert.
GluD2-Rezeptoren
Diese Rezeptoren haben eine Sonderstellung, da sie sowohl funktionell als auch strukturell keine Verwandtschaft mit anderen bekannten Glutamatrezeptoren aufweisen. Sie werden ausschließlich von Purkinjezellen im Kleinhirn exprimiert. Die Bindung von Glutamat an den GluD2-Rezeptor ist für die Funktion der Zellen essentiell.
Quellen
- ↑ Palazzo E et al. Metabotropic Glutamate Receptor 7: From Synaptic Function to Therapeutic Implications. Curr Neuropharmacol. 2016