Atrasentan
Synonyme: ABT-627
Handelsname: Xinlay®, Vanrafia®
Definition
Atrasentan ist ein Arzneistoff aus der Gruppe der Endothelin-Rezeptorantagonisten (ERA), der in den USA zur Behandlung von Proteinurie bei primärer IgA-Nephropathie zugelassen ist.
Chemie
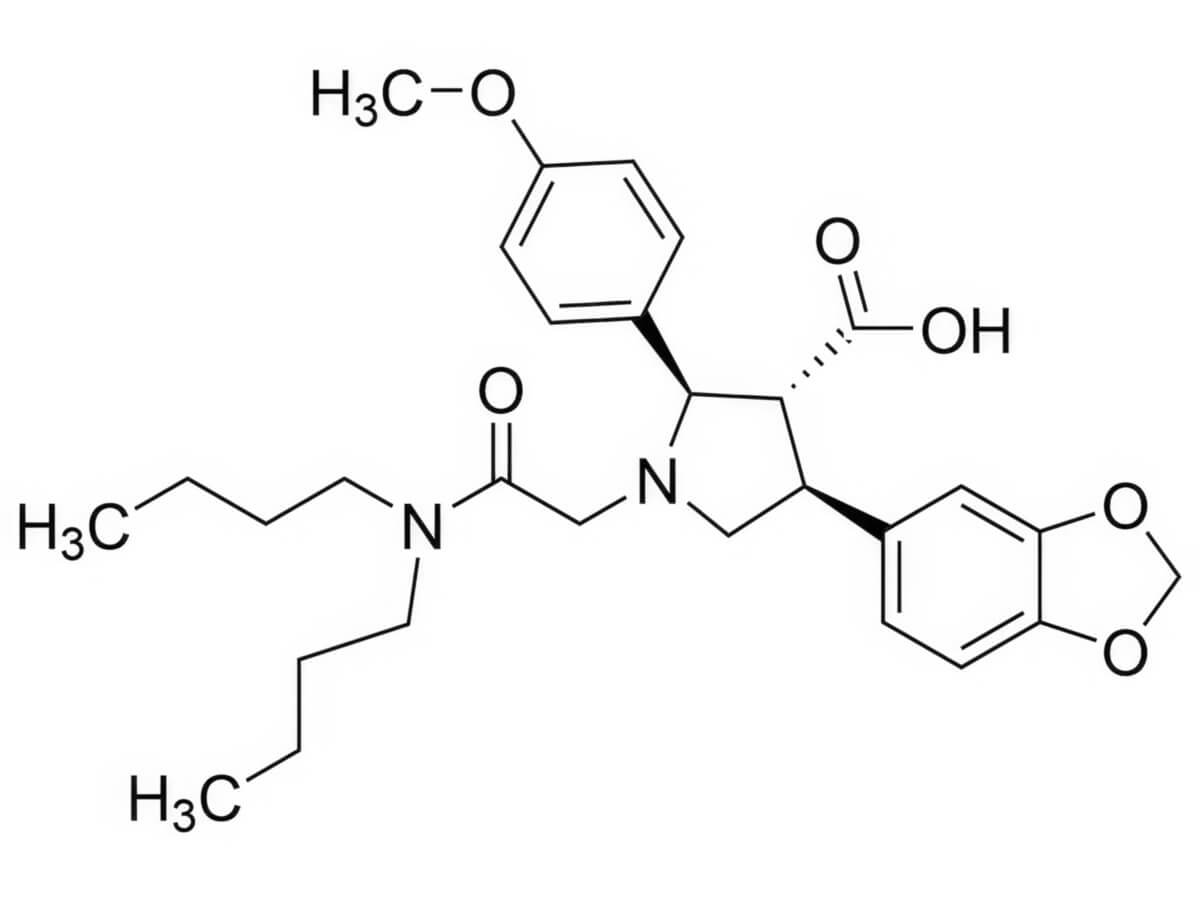
Atrasentan besteht aus mehreren Ringsystemen mit einer zentralen Prolin-Einheit. Aufgrund dessen hat der Wirkstoff zwitterionische Eigenschaften. Die Summenformel lautet C29H38N2O6; das Molekulargewicht beträgt 510,6 g/mol .[1]
Wirkmechanismus
Atrasentan bindet an den Subtyp A des Endothelinrezeptors (ETA). Dadurch blockiert er die Endothelin-induzierte Zellproliferation. Die verwandten Wirkstoffe Sitaxentan und Ambrisentan haben einen vasokonstriktorischen Effekt.[2]
Bei Patienten mit diabetischer Nephropathie konnte durch Atrasentan die Albuminausscheidung im Urin als Surrogatendpunkt um rund 35% gesenkt werden. Der Einfluss auf primäre Endpunkte (z.B. Mortalität) wurde nicht untersucht.[3]
Pharmakokinetik
Das Verteilungsvolumen beträgt 1180 Liter, die Eliminationshalbwertszeit 24 bis 41 Stunden.
Indikation
- Reduktion von Proteinurie bei erwachsenen Patienten mit primärer Immunoglobin-A-Nephropathie mit dem Risiko für eine schnelle Krankheitsprogression (Protein-Kreatinin-Quotient, UPCR) 1,5 g/g)
Onkologie
Atrasentan wurde ebenfalls als mögliches Zytostatikum untersucht. In klinischen Studien bei fortgeschrittenem Prostatakarzinom konnte jedoch gegenüber der Standardtherapie keine überzeugende Wirkung von Atrasantan nachgewiesen werden.[4] Der Wirkstoff wurde daraufhin in der Indikation "Prostatakarzinom" nicht von der FDA zugelassen.
Darreichungsform
Atrasentan ist als Tablette erhältlich.
Dosierung
Die empfohlene Dosierung beträgt 0,75 mg einmal täglich.
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkung
- embryofetale Toxizität
- Leberschädigung: Da manche Endothelin-Rezeptor-Antagonisten zu einer Erhöhung von Leberenzymen führen, sollten vor Beginn der Therapie mit Atrasentan die Leberwerte überprüft und regelmäßig kontrolliert werden.
- verringerte Spermienanzahl (Oligospermie)
- periphere Ödeme
- Anämie
Wechselwirkungen
- Da Atrasentan ein CYP3A4-Substrat ist, sollte die gleichzeitige Anwendung mit CYP3A4-Induktoren vermieden werden.
- Da Atrasentan ein OATP1B1- und OATP1B2-Substrat ist, sollte die gleichzeitige Anwendung mit OATP1B1/2-Inhibitoren vermieden werden.
Kontraindikationen
- Überempfindlichkeit gegen den Wirkstoff
- Schwangerschaft
Zulassung
In den USA erfolgte die Zulassung unter einem beschleunigten Zulassungsverfahren im Frühjahr 2025. In der EU ist der Wirkstoff zur Zeit (2025) noch nicht zugelassen. Es wird kritisch geprüft, ob Atrasentan auch den Rückgang der Nierenfunktion verlangsamt.
Quellen
- ↑ Atrasentan: Pubchem; aufgerufen am 02.05.2025
- ↑ Vanrafia: Prescribing information (Fachinformation); aufgerufen am 02.05.2025
- ↑ de Zeeuw, D et al.: "The endothelin antagonist atrasentan lowers residual albuminuria in patients with type 2 diabetic nephropathy". Journal of the American Society of Nephrology. 25 (5): 1083–93 (May 2014), doi:10.1681/ASN.2013080830. PMC 4005314 PMID 24722445
- ↑ Quinn, D et al.: "Docetaxel and atrasentan versus docetaxel and placebo for men with advanced castration-resistant prostate cancer (SWOG S0421): a randomised phase 3 trial". The Lancet Oncology. 14 (9): 893–900 (August 2013) doi:10.1016/S1470-2045(13)70294-8. PMC 4277263 PMID 23871417