Parietalzelle
von lateinisch: paries - Wand
Synonyme: Belegzelle, Exocrinocytus parietalis, oxyntische Zelle (gr. "oxys" - "sauer")
Englisch: parietal cell, acid cell, oxyntic cell
Definition
Parietalzellen sind große, mit Eosin stark anfärbbare Drüsenzellen in der Magenmukosa von Fundus und Corpus ventriculi.
Gelegentlich werden auch die im Glomerulus der Niere vorkommenden parietalen Epithelzellen als Parietalzellen bezeichnet.
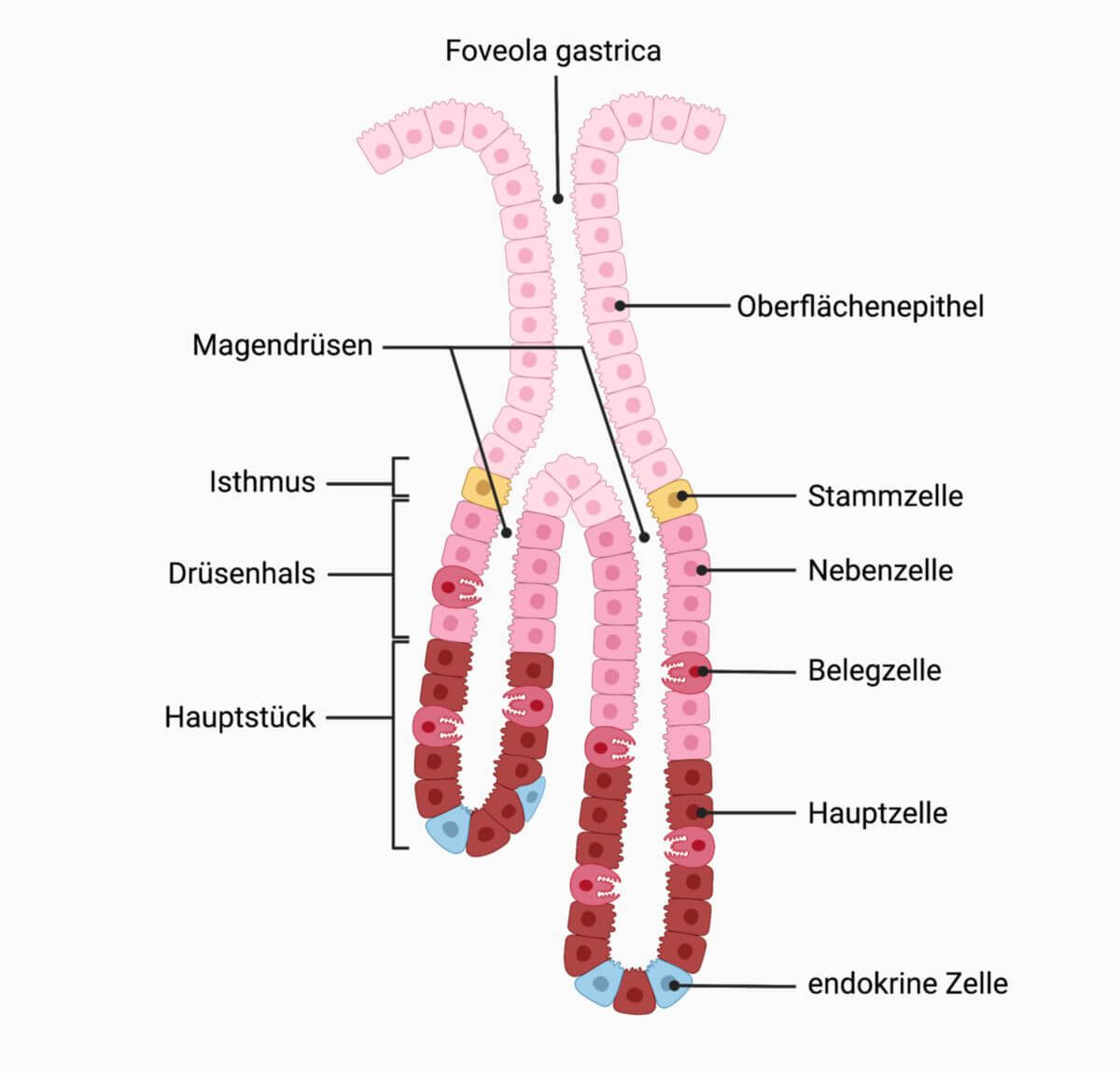
Histologie
Parietalzellen stellen sich in der HE-Färbung als Zellen mit intensiv eosinophilem Zytoplasma dar. Im histologischen Präparat wölben sie sich etwas in die Lamina propria der Mukosa vor.
In der Elektronenmikroskopie fallen die Zellen durch ihre Mikrovilli und Canaliculi auf, kleine Fortsätze bzw. kanalartige Einfaltungen der Zellmembran, die der Oberflächenvergrößerung dienen. Die Anzahl dieser Canaliculi wird dynamisch an die Sekretionsleistung der Parietalzelle angepasst. Im membrannahen Zytoplasma befindliche Tubulovesikel können dazu bei Bedarf mit der Zellmembran verschmolzen werden. Bei sinkender Sekretionsleistung werden die Canaliculi von der Parietalzelle umgekehrt wieder als Tubulovesikel internalisiert. Durch diese Abläufe haben Parietalzellen von allen Körperzellen die größte Membranfusionsleistung.[1]
Funktion
Parietalzellen sind in der Lage, aus Kohlensäure Protonen abzuspalten und auf ihrer apikalen Seite im Austausch gegen Kalium-Ionen zu sezernieren. Zu diesem Zweck besitzen sie in der Zellmembran Protonen-Kalium-Pumpen. Daneben transportieren sie Chlorid-Ionen von der basalen Seite durch ihr Zytosol und geben sie ebenfalls ins Magenlumen ab. Die so entstehende Salzsäure ist für den niedrigen pH-Wert des Magensaftes verantwortlich.
Parietalzellen sezernieren darüber hinaus den Intrinsic Factor, der für die Resorption von Cobalamin essentiell ist.
Regulation
Parietalzellen reagieren mit absteigender Intensität auf drei verschiedene Stimuli:
- Histamin, das H2-Rezeptoren stimuliert
- Acetylcholin, das durch die parasympathische Aktivität des Nervus vagus ausgeschüttet wird und auf die Μ3-Rezeptoren wirkt
- Gastrin, das die CCK2-Rezeptoren der Parietalzellen anregt
Alle Rezeptoren befinden sich auf den basolateralen Anteilen der Zellmembran. Die Aktivierung der H2-Rezeptoren führt zu einem Anstieg des intrazellulären cAMP-Spiegels, während die Stimulation der M3- und CCK2-Rezeptoren den intrazellulären Calcium-Spiegel erhöht.
Durch die erhöhten cAMP-Spiegel wird von der Parietalzelle vermehrt Proteinkinase A gebildet. Dieses Protein ist in den Transport der Protonen-Kalium-Pumpen vom Zytoplasma zur Zellmembran involviert. Gastrin regt die Säuresekretion der Parietalzelle überwiegend indirekt an, da es die Histaminsekretion der ECL-Zellen stimuliert.
Histamin, Acetylcholin und Gastrin wirken synergistisch auf die Sekretionsleistung, so dass es bei paralleler Stimulation zu einem überadditiven Effekt kommt.
Pharmakologie
Die Sekretionsleistung der Parietalzellen kann durch Protonenpumpenhemmer und H2-Antagonisten reduziert werden, so dass der Säuregehalt des Magensafts stark nachlässt. Dieser Effekt wird zum Beispiel bei der gastroösophagealen Refluxkrankheit (GERD) therapeutisch genutzt.
Quellen
- ↑ Morphological and functional transformation of the gastric parietal cell between resting and secreting states. Laboratory of John G. Forte; Department of Cell & Molecular Biology, University of California, Berkeley