Ensitrelvir
Handelsname: Xocova®
Synonyme: S-217622, Ensitrelvirfumarat
Englisch: ensitrelvir
Definition
Ensitrelvir ist ein oral verfügbares Virostatikum zur Behandlung von COVID-19. Es hemmt die virale Hauptprotease (3CL-Protease) von SARS-CoV-2 und gehört damit zu den Proteaseinhibitoren.[1]
Chemie
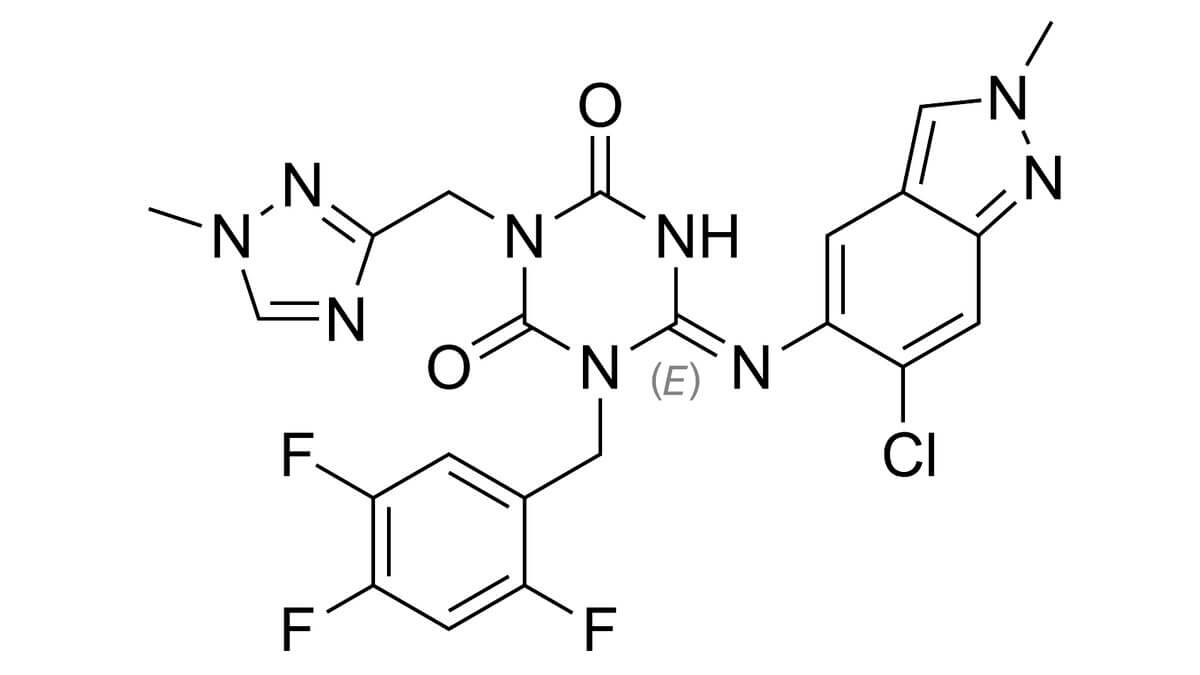
Ensitrelvir ist ein niedermolekularer Wirkstoff, der klinisch als Fumarat-Salz eingesetzt wird. Die Summenformel des Ensitrelvir-Basiswirkstoffs lautet C22H17ClF3N9O2, die molare Masse beträgt 531,88 g/mol. [2]
Wirkmechanismus
SARS-CoV-2 synthetisiert nach Eintritt in die Wirtszelle Polyproteine, die zur Virusreplikation proteolytisch prozessiert werden müssen. Ensitrelvir inhibiert die virale 3CL-Protease und verhindert dadurch die Spaltung dieser Polyproteine, wodurch die Bildung funktioneller viraler Proteine und die Virusreplikation gehemmt werden.[1] In enzymatischen Tests zeigte Ensitrelvir eine hohe Hemmpotenz (IC50 im niedrigen nmol/L-Bereich) auch gegen verschiedene 3CL-Protease-Varianten.
Pharmakokinetik
Nach oraler Gabe weist Ensitrelvir eine lange Plasmahalbwertszeit auf, die nach Mehrfachgabe in Phase-1-Kollektiven im Mittel etwa 48,7–58,9 Stunden betrug; dies unterstützt eine einmal tägliche Gabe.[3] Ein relevanter Anteil wurde unverändert ausgeschieden – u.a. ca. 28,5 % im Urin und 7,8 % im Stuhl als unverändertes Ensitrelvir.[1]
Indikationen
Darreichungsform
Dosierung
Für Jugendliche ab 12 Jahren und Erwachsene beträgt die übliche Dosierung 375 mg am Tag 1, gefolgt von 125 mg einmal täglich an den Tagen 2 bis 5.[1] Praktisch entspricht dies üblicherweise 3 Tabletten (à 125 mg) am 1. Tag und anschließend 1 Tablette täglich an den Tagen 2–5.
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkungen
In klinischen Studien traten als häufige arzneimittelbezogene Ereignisse insbesondere laborchemische Veränderungen der Lipidparameter auf, v.a. ein vorübergehender Abfall des HDL-Cholesterins sowie ein Anstieg der Triglyceride.[1] Ebenfalls berichtet wurden u.a. Anstiege von (Gesamt- und konjugiertem) Bilirubin sowie Transaminasen, ferner Kopfschmerzen, Übelkeit, Diarrhoe und Erbrechen.[1] Zudem wurden Hautreaktionen wie Exanthem und Urtikaria beobachtet.[1]
Wechselwirkungen
Ensitrelvir kann relevante Arzneimittelinteraktionen verursachen, insbesondere über CYP3A. In einer klinischen Studie führte die Gabe von Ensitrelvir zu einer deutlichen Erhöhung der Exposition des CYP3A-Substrats Midazolam, was als starke CYP3A-Inhibition gewertet wird.[5] Umgekehrt kann die Exposition von Ensitrelvir durch starke CYP3A-Induktoren deutlich vermindert werden. Unter Carbamazepin sank die Ensitrelvir-Exposition in der Auswertung etwa um ~50 %, was einen Wirkverlust begünstigen kann.[1] Starke CYP3A-Inhibitoren (z.B. Itraconazol) erhöhten die Ensitrelvir-Exposition moderat.[1] Klinisch besonders relevant ist zudem, dass Ensitrelvir durch seinen starken CYP3A-hemmenden Effekt die Colchicin-Exposition erhöhen kann. Bei gleichzeitiger Colchicintherapie und vorbestehender Leber- oder Nierenfunktionsstörung wird dies als Kontraindikation geführt.[1]
Kontraindikationen
Kontraindikationen und wichtige Anwendungsbeschränkungen ergeben sich vor allem aus Interaktionsrisiken, wie z.B.:
- gleichzeitige Anwendung starker CYP-Induktoren
- Kombination mit Colchicin bei Patienten mit Leber- oder Nierenfunktionsstörung[1]
Zulassung
In Japan erhielt Ensitrelvir 2022 zunächst eine Notfallzulassung und 2024 eine reguläre Zulassung zur Behandlung von COVID-19.[1] In Singapur war Ensitrelvir über ein Special-Access-Route-Verfahren verfügbar.[4] In den USA prüft die FDA aktuell (2026) die Zulassung zur Postexpositionsprophylaxe.[6] Der Wirkstoff ist bisher (2026) in Europa nicht zugelassen.
Quellen
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 Pharmaceuticals and Medical Devices Agency (PMDA): Xocova Tablets 125 mg – Review report (January 19, 2024)
- ↑ FDA GINAS: ENSITRELVIR (UNII PX665RAA3H)
- ↑ Shimizu R, et al.: A Phase 1 Study of Ensitrelvir Fumaric Acid Tablets… Clin Drug Investig. 2023;43:785–797.
- ↑ 4,0 4,1 Shionogi: SAR approval in Singapore regarding ensitrelvir fumaric acid… (19.12.2023)
- ↑ Shimizu R, et al.: Evaluation of the Drug–Drug Interaction Potential of Ensitrelvir… Clin Drug Investig. 2023;43:335–346.
- ↑ Shionogi: FDA accepts Shionogi’s ensitrelvir NDA… (02.09.2025)