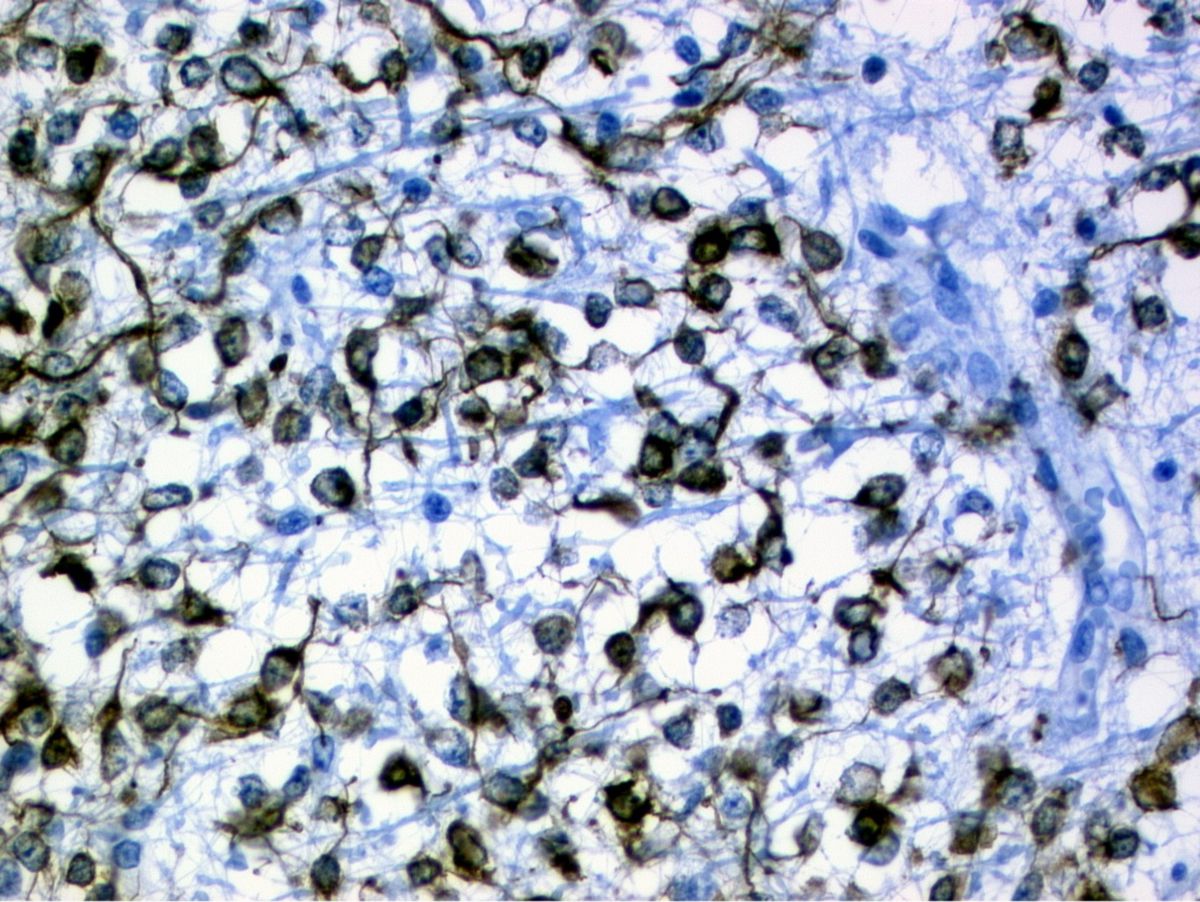
Glioblastom
Synonyme: Glioblastoma multiforme (veraltet; multiforme -> stark variables Erscheinungsbild des Tumors), GBM, Grad IV Astrozytom
Englisch: glioblastoma
Definition
Glioblastome gehören zu den diffus infiltrierenden, hochmalignen Gliomen und sind die häufigsten hirneigenen Neoplasien. Sie haben nach der WHO-Klassifikation von 2021 den ZNS-WHO-Grad 4 und gehen meist mit einer schlechten Prognose einher.
Klassifikation
Die Einteilung der Glioblastome erfolgt anhand der WHO-Klassifikation, die zuletzt 2021 überarbeitet wurde.[1][2]
Bestimmend für die Klassifikation sind der IDH-Mutationsstatus und histologische Merkmale des Tumors. Das Glioblastom mit IDH-Wildtyp wird in der Kategorie "diffuse Gliome vom adulten Typ" eingeordnet.
Ehemals wurde zwischen dem "Glioblastom, IDH-Wildtyp" und dem "Glioblastom, IDH-mutiert" unterschieden. Letzteres wird mittlerweile als "Astrozytom, IDH-mutiert, WHO-Grad 4" klassifiziert. Es tritt eher bei jüngeren Patienten auf, entwickelt sich aus einem vorbestehenden niedriggradigeren Astrozytom und sollte daher von einem primären Glioblastom abgegrenzt werden. IDH-mutierte Astrozytome sind in der Regel weniger aggressiv als IDH-Wildtyp-Glioblastome.[3]
Epidemiologie
Die Hälfte aller Astrozytome sind Glioblastome. Es handelt sich bei einem Anteil von 15 % um den häufigsten hirneigenen Tumor überhaupt. Die meisten Patienten erkranken zwischen dem 45. und 60. Lebensjahr, allerdings können auch Jugendliche und Kinder erkranken. Das Glioblastom ist der dritthäufigste Tumor bei Kindern unter 2 Jahren.
Ätiologie
Alle Glioblastome entstehen durch pathologische Vermehrung von veränderten Astrozyten und gehören histologisch zur Gruppe der Astrozytome. Als genetische Alterationen sind Mutationen der Tumorsuppressorgene p53 (> 30 %) und p16 (> 50 %), Deletionen auf Chromosom 10 (> 60 %) und 19q (25 %) sowie eine Amplifikation des EGF-Rezeptors (> 30 %) gefunden worden. Einen bekannten Einfluss auf die Tumorgenese haben zudem Mutationen der Isocitratdehydrogenase (IDH), die zu einer vermehrten Bildung von 2-Hydroxyglutarat führen. Dieses wirkt als Onkometabolit über die Methylierung von DNA und Histonen. Zudem scheinen Veränderungen im ATRX-Gen für die Entwicklung von niedriggradigen Astrozytomen bis zum sekundären Glioblastom bedeutsam zu sein.[4]
Bekannte Risikofaktoren für die Entstehung von Glioblastomen sind das Lynch-Syndrom und das Li-Fraumeni-Syndrom.
Pathogenese
Glioblastome wachsen schnell und können sich innerhalb von wenigen Wochen entwickeln. Dabei kann die eigentliche Tumorentstehung jedoch schon mehrere Jahre zurückliegen. Die typische Lokalisation ist tief frontotemporal. Die Ausbreitung erfolgt entlang von Trakten innerhalb der weißen Substanz. Auch die Meningen und die Dura mater werden infiltriert. Metastasen außerhalb des ZNS sind selten. Innerhalb des ZNS erfolgt die Metastasierung kontinuierlich oder über den Liquor cerebrospinalis in Form sogenannter Abtropfmetastasen. 3 bis 6 % der Glioblastome sind primär multizentrisch. Ebenso ist es möglich, dass sich das Glioblastom von der einen Hemisphäre über den Balken auf die andere Hemisphäre ausbreitet. Dieses eher seltene Bild nennt man Schmetterlingsgliom.
Die Symptomatik kommt v.a. durch Kompression benachbarter Strukturen zustande. Je maligner der Tumor, desto ausgeprägter ist die Reaktion des umgebenden Parenchyms in Form eines perifokalen Ödems, das ausgeprägt raumfordernd wirkt.
High-grade-Gliome zeichnen sich durch eine stark heterogene Tumormikroumgebung (TME) aus. Die TME von High-grade-Gliomen besteht aus komplexen Interaktionen zwischen Tumorzellen, Stromazellen, Immunzellen, Fibroblasten sowie weiteren Zellen. Dieses TME ist funktional immunsuppressiv, was für Immuntherapien eine große Herausforderung darstellt. Die Immunsuppression entsteht primär durch Zytokine wie IL-6 und TGF-β, durch Checkpoint-Liganden wie PD-L1 sowie durch eine verstärkte M2-Polarisierung der Tumor-assoziierten Makrophagen.[5]
Symptomatik
Das Symptommuster ist weniger durch die Raumforderung des Tumors, sondern vor allem durch das perifokale Ödem gegeben, sodass viele Patienten nach pharmakologischer Ödemreduktion sogar vorübergehend symptomfrei werden können.
Einerseits treten fokale Symptome, wie z.B. Paresen, fokale bzw. generalisierte epileptische Krampfanfälle, Schwindel oder Persönlichkeitsveränderungen und Verhaltensauffälligkeiten auf. Darüber hinaus können durch einen erhöhten Hirndruck Symptome wie Kopfschmerzen, Übelkeit, Erbrechen oder Bewusstseinsstörungen entstehen. Bei Blutung oder Verlegung des Liquorabflusses können zudem Symptome eines Schlaganfalls oder Hydrozephalus hinzukommen.
Ebenso ist es möglich, dass der Patient symptomfrei ist und der Tumor ein Zufallsbefund ist.
Diagnostik
Zusammen mit der Lokalisation, den radiologischen tumorspezifischen Besonderheiten und dem Erkrankungsalter lässt sich häufig bereits eine Verdachtsdiagnose stellen. Eine detaillierte neurologische und neuropsychologische Untersuchung dient der Einschätzung der durch den Tumor verursachten Beeinträchtigungen und hilft im Verlauf dabei, Zeichen für eine Tumorprogression oder eines möglichen Therapieansprechens zu erkennen.
Bildgebung
Bildgebende Methode der Wahl ist die Kernspintomografie (mit und ohne Kontrastmittel).
Kalzifikationen (Verkalkungen) stellen sich am besten in der Computertomografie dar. Die CT zeigt ein Glioblastom als eine heterogene, in 85 % zystische Läsion mit Verkalkungen und nekrotischen Arealen. In der Angiographie erscheint eine Gefäßmasse mit arterio-venösen Kurzschlüssen und verfrühter venöser Drainage.
Liquordiagnostik
Die Liquordiagnostik spielt insbesondere bei der Abgrenzung von Differenzialdiagnosen (z.B. Hirnabszess, entzündliche Erkrankungen, primär zerebrales Lymphom, Metastasen) eine Rolle. In Studien wurde zellfreie Tumor-DNA im Liquor von Gliom-Patienten nachgewiesen. Eine mögliche Früherkennung über den Liquor ist aktueller Forschungsgegenstand (2025).
CAVE: Bei Anzeichen eines erhöhten Hirndrucks oder bei infratentoriellen Läsionen mit Einklemmungsgefahr ist eine Lumbalpunktion kontraindiziert.
Pathologie
Die Diagnose kann entweder durch eine stereotaktische Biopsie oder durch histopathologische Untersuchung des während der Tumorexstirpation gewonnenen Gewebes gesichert werden.
Makroskopisch handelt es sich um einen heterogenen, mit Zysten durchsetzten, degenerativ veränderten Tumor mit zahlreichen Nekrosen.
Mikroskopisch zeigen sich folgende Merkmale:
- ausgeprägtes Ödem
- Zellreichtum
- Kernatypien
- Mitoserate > 10 %
- Pseudopallisaden am Tumorrand
- endovaskuläre Hyperplasie mit pathologischen Gefäßglomerula
Zur histopathologischen Einordnung wird u.a. der Mutationsstatus der Isocitratdehydrogenase-1 und -2 (IDH1/2) bestimmt. Zudem sind eine Amplifikation von EGFR, Promotormutationen des TERT-Gens und/oder ein Gewinn von Chromosom 7 in Kombination mit einem Verlust von Chromosom 10 mit einem Glioblastom assoziiert.
Beim Glioblastom findet sich auf molekularer Ebene zudem häufig eine MGMT-Promotor-Hypermethylierung, die insbesondere für die Auswahl einer Chemotherapie von Bedeutung ist.
Therapie
Eine Heilung ist i.d.R. nicht möglich. Ziel der Therapie ist es, die Tumormasse chirurgisch weitgehend zu reduzieren (Komplettresektion wird angestrebt), eine Progression medikamentös zu verzögern und so Symptome zu lindern und die Lebensqualität möglichst lange zu erhalten.
Präoperatives Management
Präoperativ spielt die Reduktion des peritumoralen Ödems mit Kortikosteroiden eine wichtige Rolle. Zudem ist es wichtig, der Entwicklung eines postoperativen Ödems entgegenzuwirken. Bei ausgeprägtem Ödem werden zusätzlich zu Kortikosteroiden auch osmotisch wirksame Substanzen (z.B. Mannitol) eingesetzt.
Operative Therapie
Da die Glioblastome ein ausgesprochen infiltratives Wachstum zeigen, ist eine Heilung durch Resektion des Tumors leider nicht möglich.
Um das Tumorgewebe von gesundem Hirngewebe unterscheiden zu können, werden Stoffe wie 5-Aminolävulinsäure eingesetzt, das sich im Tumor anreichert und unter UV-Licht fluoresziert.
Zur Verbesserung des Operationsergebnisses und zur Minimierung postoperativer Defizite werden verschiedene Methoden eingesetzt. Patienten erhalten intraoperativ ein neurophysiologisches Monitoring. Des Weiteren werden Wachoperationen durchgeführt, sofern das Glioblastom in einer Hirnregion liegt, die besonders sensibel für sprachliches Verständnis und Sprachproduktion ist. So kann durch intraoperative, psychologische Testungen überprüft werden, wie weit der Tumor resiziert werden darf, ohne dass neurologische Defizite auftreten.
Außerdem wird intraoperativ die sogenannte Neuronavigation eingesetzt, um die räumliche Orientierung des Operateurs durch eine gezielte Bildgebung zu verbessern.
Radiochemotherapie
Adjuvant erfolgt die Behandlung nach dem Stupp-Schema durch eine Radiochemotherapie mit Temozolomid. Eine Methylierung des MGMT-Promoters verbessert den Einfluss der Chemotherapie und verlängert das Überleben geringfügig.[6] Ein Rezidiv kann aber nicht verhindert werden. Es wird diskutiert, ob eine zusätzliche Gabe des Alkylans Lomustin bei MGMT-Promotor-methyliertem Glioblastom einen Zusatznutzen bringt.[7]
Zusätzlich wird auch Bevacizumab eingesetzt. Eine Studie von 2017 konnte bei progressiven Glioblastomen jedoch keine Erhöhung der Überlebensrate durch die gemeinsame Verabreichung von Bevacizumab und Lomustin, im Vergleich zur alleinigen Gabe von Lomustin, feststellen.[8]
Tumortherapiefelder
Ein weiteres Verfahren, dass ein progressionsfreies Überleben mittels elektromagnetischer Wechselfelder verlängern soll, sind die sogenannten Tumortherapiefelder (TTfields, TTF). Die genaue Wirkmechanismus des Verfahrens ist unklar. Die Wechselfelder behindern vermutlich die Ausbildung des Spindelapparates und damit die korrekte Ausrichtung der Schwesterchromatiden. Dies resultiert in einer Störung der Zellteilung (Mitose), insbesondere während der Anaphase.
Das Verfahren ist seit 2011 in den USA zugelassen und darf auch in Deutschland durchgeführt werden. In einer 2017 veröffentlichten Phase-III-Studie mit 692 Patienten wurde gezeigt, dass die Progression bei einer Behandlung mit TTF plus Temozolomid bei 6,7 Monaten lag, im Fall der alleinigen Gabe von Temozolomid nur bei 4,0.[9]
Eine prinzipielle Kostenübernahme durch die gesetzliche Krankenversicherung wurde 2020 in einer Entscheidung des Gemeinsamen Bundesausschusses (GBA) empfohlen.[10] Seit 2021 werden TTF zudem unter bestimmten Voraussetzungen als Therapieoption für neu diagnostizierte Glioblastome in den Leitlinien der DGN und der DGHO aufgeführt.
Immuntherapie
Die Möglichkeit der Krebsimmuntherapie ist derzeit (2025) Gegenstand der Forschung. Verfahren wie die intrathekale CAR-T-Zell-Therapie, die zwei Tumorantigene (EGFR und IL-13Rα2) gleichzeitig adressiert, zeigen erste positive Studienergebnisse (verringerte Tumormasse bei zwei Drittel der Patienten in einer Phase-1-Studie). In Einzelfällen kam es zu einer längerfristigen Krankheitskontrolle (> 12 Monate, Stand 06/2025), was bei dieser aggressiven Tumorentität selten ist.[11]
Prävention
Eine Früherkennung spielt bislang keine Rolle. Eine Ausnahme sind hereditäre Tumorsyndrome, die mit einer erhöhten Wahrscheinlichkeit für die Entwicklung von Gliomen einhergehen (z.B. Li-Fraumeni-Syndrom).
Prognose
Die Prognose des GBM ist schlecht. Die mittlere Überlebenszeit beträgt trotz Behandlung oft nur 8 bis 18 Monate. Großzellige GBMs haben eine geringfügig bessere Prognose als kleinzellige.
Quellen
- ↑ Weller et al., Die WHO-Klassifikation der Tumoren des zentralen Nervensystems 2021 – Neuerungen zur Diagnostik diffuser Gliome und deren Bedeutung für die klinische Praxis, Der Onkologe, 2022
- ↑ Louis et al: The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary Acta Neuropathologica, 2016
- ↑ Julie J Miller et al.: Isocitrate dehydrogenase (IDH) mutant gliomas: A Society for Neuro-Oncology (SNO) consensus review on diagnosis, management, and future directions, Neuro-Oncology, Volume 25, Issue 1, January 2023, Pages 4–25, https://doi.org/10.1093/neuonc/noac207
- ↑ Onkopedia-Leitlinie: Gliome im Erwachsenenalter 2019
- ↑ Razavi SM, et al.: Immune evasion strategies of glioblastoma. Front. Surg. 2016;3:11. doi: 10.3389/fsurg.2016.00011
- ↑ Binabaj MM et al.: The prognostic value of MGMT promoter methylation in glioblastoma: A meta-analysis of clinical trials. J Cell Physiol. 2018 Jan;233(1):378-386. doi: 10.1002/jcp.25896. Epub 2017 May 16.
- ↑ Herrlinger et al., Lomustine-temozolomide combination therapy versus standard temozolomide therapy in patients with newly diagnosed glioblastoma with methylated MGMT promoter (CeTeG/NOA-09): a randomised, open-label, phase 3 trial, Clinical Trial, Lancet, 2019
- ↑ Wick W, Gorlia T, Bendszus M et al.: Lomustine and Bevacizumab in Progressive Glioblastoma. N Engl J Med. 2017 Nov 16;377(20):1954-1963. doi: 10.1056/NEJMoa1707358.
- ↑ Stupp R, Taillibert S et al Effect of Tumor-Treating Fields Plus Maintenance Temozolomide vs Maintenance Temozolomide Alone on Survival in Patients With Glioblastoma: A Randomized Clinical Trial. AMA. 2017
- ↑ GBA Pressemitteilung - Behandlung von Glioblastomen mit Tumortherapiefeldern wird verordnungsfähig, abgerufen am 27.05.2022
- ↑ CAR-T-Zell-Therapie-Phase-1-Studie