Larotrectinib
Handelsname: Vitrakvi®
Synonyme: LOXO-101, ARRY-470
Englisch: larotrectinib
Definition
Larotrectinib ist ein Arzneistoff mit antineoplastischer Aktivität aus der Gruppe der Tyrosinkinaseinhibitoren, der zur Untergruppe der TRK-Inhibitoren zählt. Er hemmt selektiv die Tropomyosinrezeptorkinasen TrkA, TrkB und TrkC.
Chemie
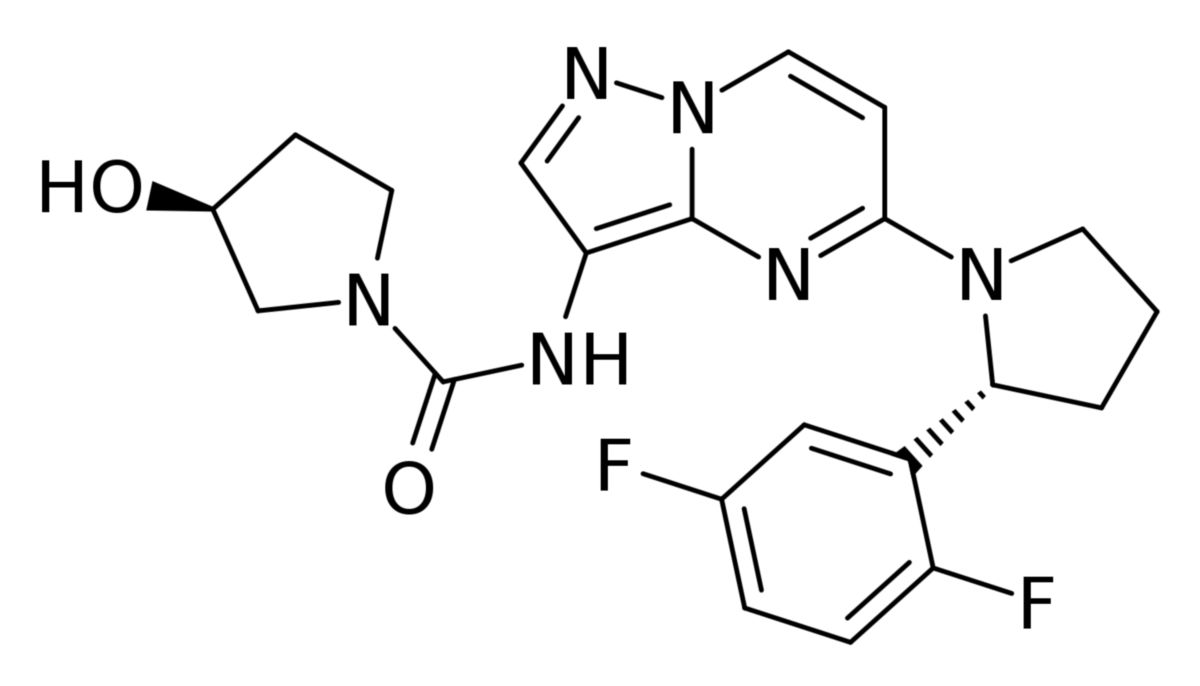
Die Summenformel von Larotrectinib ist C21H22F2N6O2. Die molare Masse beträgt 428,4 g/mol.
Wirkmechanismus
Larotrectinib bindet selektiv an Tropomyosinrezeptorkinasen (Trk) und blockiert deren Aktivierung. Dadurch kommt es bei Krebszellen, die ein NTRK-Fusionsgen besitzen und konstitutiv aktive Trk-Proteine exprimieren, zur Störung der intrazellulären Signalkaskade. Dies führt letztlich zu einer Apoptose der Krebszellen und damit zu einer Hemmung des Tumorwachstums.
Voraussetzungen
Voraussetzung für die Behandlung mit Larotrectinib ist eine Tumorprofilanalyse mit Identifikation und Analyse der vorliegenden Mutationen und ihrer Auswirkungen. Dazu wird eine Biopsie des Tumors entnommen und das Tumorgenom sequenziert (Next-Generation-Sequencing).
Indikation
- Behandlung metastasierter solider Tumoren, bei denen ein NTRK-Fusionsgen nachgewiesen wurde
Klinische Wirkung
Larotrectinib wurde in einer Basket-Studie an 55 erfolglos vorbehandelten Patienten getestet, bei denen ein NTRK-Fusionsgen nachgewiesen werden konnte. Die Patienten litten an verschiedenen lokal fortgeschrittenen oder metastasierten malignen Tumoren, u.a. an Darmtumoren, Mammakarzinomen, Cholangiokarzinomen, Fibrosarkomen, Bronchialkarzinomen, Speicheldrüsentumoren , Melanomen, Pankreaskarzinomen, Schilddrüsenkrebs oder Sarkomen.
Primärer Endpunkt war die Gesamtansprechrate. Sie betrug nach zentraler Auswertung 75 %, davon 13 % komplett, die übrigen 62 % partiell. Nach einem Jahr zeigten noch 71 % ein Ansprechen auf die Therapie, 55 % waren progressionsfrei.
Darreichungsform
Dosierung
Nebenwirkungen
- Fatigue
- Erbrechen
- Schwindel
- Anstieg der Leberenzyme
Wechselwirkungen
Bei gleichzeitiger Gabe von Arzneistoffen, die Inhibitoren oder Induktoren von CYP3A4 sind, ist eine Dosisanpassung von Larotrectinib erforderlich, falls ein Absetzen der Medikamente nicht möglich ist. Bei gleichzeitiger Gabe von CYP3A4-Inhibitoren sollte die Tagesdosis von Larotrectinib um 50 % reduziert werden. Umgekehrt wird bei gleichzeitiger Gabe von CYP3A4-Induktoren eine Dosisverdoppelung empfohlen.
Zulassung
Larotrectinib wurde vom amerikanischen Biotech-Unternehmen Array BioPharma entwickelt und 2013 an Loxo Oncology lizensiert. Die weltweiten Vertriebsrechte gingen 2017 gegen eine Zahlung von 400 Mio. US$ an Bayer. Der Wirkstoff wurde im November 2018 von der FDA zugelassen. Der Zulassungsantrag bei der EMA wurde im August 2018 gestellt. Daraufhin erfolgte im September 2019 die Zulassung in der EU.
Kosten
Die monatlichen Therapiekosten in den USA liegen vor evtl. Rabatten bei 32.800 US-$, die Jahrestherapiekosten bei rund 390.000 US-$.[1]
Quellen
- ↑ Loxo And Bayer's Amazing Drug Has An Expensive Price. Matthew Herper Forbes Healthcare Nov 26, 2018, abgerufen am 27.11.2018