Baloxavirmarboxil
Synonym: S-033188
Handelsname: Xofluza®
Definition
Baloxavirmarboxil ist ein Virustatikum aus der Gruppe der CAP-Endonuclease-Inhibitoren mit Wirksamkeit gegen das Influenzavirus.
Chemie
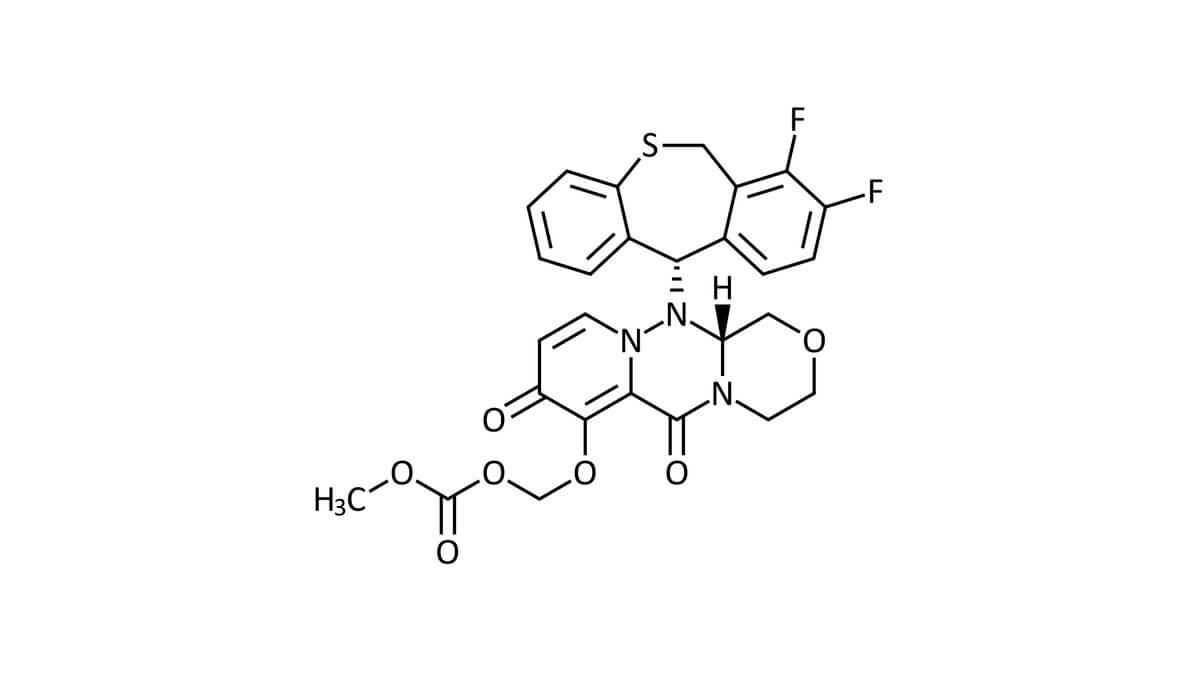
Baloxavirmarboxil ist ein polyzyklisches Molekül mit einer Benzothiepin-Grundstruktur. Der Arzneistoff ist basisch.
Das Molekulargewicht beträgt 571,6 g/mol; die Summenformel lautet C27H23F2N2O7S.[1]
Wirkmechanismus
Baloxavirmarboxil hemmt die Endonuclease-Aktivität der PA-Untereinheit der RNA-Polymerase von Influenza A und Influenza B.[2] Dieses Enzym ist für die Transkription der viralen RNA wichtig. Somit wird die Virusvermehrung blockiert und die Krankheitsdauer um durchschnittlich einen Tag reduziert.
Vermutlich wirkt Baloxavir auch in der Postexpositionsprophylaxe.[3]
Pharmakokinetik
Die Zeit bis zum Erreichen des maximalen Plasmaspiegels beträgt 4 Stunden. Nach der Resorption wird Baloxavirmarboxil in den aktiven Metaboliten Marboxil umgewandelt. Bei gleichzeitiger Einnahme einer Mahlzeit kann die Bioverfügbarkeit um bis zu 48% verringert sein.
Die Plasmaproteinbindung beträgt 92,9 bis 93,9%, das Verteilungsvolumen etwa 1.180 Liter. Die Biotransformation erfolgt primär über UGT1A3. Die biologische Halbwertszeit liegt bei 79,1 Stunden.
Indikation
- Behandlung einer unkomplizierten Influenza ab 12 Jahren
- Postexpositionsprophylaxe einer Influenza ab 12 Jahren[4]
Dosierung und Darreichungsform
Die Einmaldosis ist innerhalb von 48 Stunden einzunehmen. Bei Personen mit einem Körpergewicht unter 80 kg beträgt die Einmaldosis 40 mg (zweimal 20 mg); bei einem Körpergewicht über 80 kg beträgt sie 80 mg (zweimal 40 mg).
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Klinische Wirkung
Die klinische Wirksamkeit wurde in den Zulassungsstudien Capstone 1 und Capstone 2 nachgewiesen, in denen Baloxavirmarboxil gegen Oseltamivir und Placebo verglichen wurde. Die Krankheitsdauer verringerte sich im Vergleich zu Placebo um 27 Stunden. Bei 5 bis 10 % der Patienten bildeten sich Resistenzen gegen Baloxavirmarboxil.
In der Blockstone-Studie wurde Baloxavirmarboxil in der Anwendung der Postexpositionsprophylaxe getestet. Mit Baloxavirmarboxil behandelte Patienten erkrankten in 1,9 % der Fälle (Placebo: 13,6 %).[5]
Nebenwirkungen
Unerwünschte Wirkungen wie Diarrhö, Bronchitis, Kopfschmerzen und Übelkeit traten in klinischen Studien mit vergleichbarer Häufigkeit wie in der Placebogruppe auf. Nebenwirkungen nach der Markteinführung sind anaphylaktische Reaktionen, Hypersensitivität, Urtikaria und angioneurotisches Ödem.[4]
Wechselwirkungen
Kontraindikationen
- Überempfindlichkeit gegen den Wirkstoff
Da noch keine ausreichenden Daten vorliegen, wird die Einnahme in der Schwangerschaft und Stillzeit nicht empfohlen.
Zulassung
Der Wirkstoff ist seit 2019 in Japan und in den USA zugelassen, seit 2021 in der EU. Er wurde von Shionogi & Co. Limited in Kooperation mit Hoffmann-La Roche entwickelt.
Aufgrund einer negativen Nutzenbewertung durch den G-BA hat der Hersteller Baloxavir vom deutschen Markt genommen.[6]
Literatur
- Koszalka P et al. Influenza antivirals currently in late-phase clinical trial, Influenza Other Respir Viruses. 2017 May;11(3):240-246, abgerufen am 02.09.2019
- Hayden FG et al. Baloxavir Marboxil for Uncomplicated Influenza in Adults and Adolescents, N Engl J Med. 2018 Sep 6;379(10):913-923, abgerufen am 02.09.2019
Quellen
- ↑ Baloxavirmarboxil in der pubchem-Datenbank, aufgerufen am 09.04.2021
- ↑ Noshi T et al. In vitro characterization of baloxavir acid, a first-in-class cap-dependent endonuclease inhibitor of the influenza virus polymerase PA subunit, Antiviral Res. 2018 Dec;160:109-117, abgerufen am 02.09.2018
- ↑ Müller C. Baloxavir reduziert Ansteckungsgefahr bei Grippe, DAZ 04.06.2019, abgerufen am 02.09.2019
- ↑ 4,0 4,1 4,2 Fachinformation zu Xofluza, fachinfo.de, aufgerufen am 09.04.2021
- ↑ Brigitte M. Gensthaler: Baloxavir, Inclisiran und Isatuximab. In Pharmazeutische Zeitung 9/2021, S. 16f.
- ↑ Deutsche Apotheker-Zeitung: Kein Xofluza mehr für Deutschland, 14.10.2021, aufgerufen am 15.10.2021