Radikalische Substitution
von lateinisch: substituere - ersetzen
Synonym: Radikalische Kettenreaktion
Englisch: radical substitution
Definition
Unter einer radikalischen Substitution, abgekürzt SR, versteht man in der organischen Chemie eine sehr schnell ablaufende Kettenreaktionen. Dabei wird an einem sp3-substituierten Kohlenstoffatom ein Wasserstoffatom ersetzt. Häufig wird an dieser Stelle ein Halogen- oder Sauerstoffatom eingefügt.
Ablauf
Die Reaktion verläuft in drei Reaktionsschritten:
- Startreaktion: Radikalbildung
- Kettenfortpflanzung
- Kettenabbruch durch Rekombination
Eine radikalische Substitution erfolgt nur dann, wenn eine Bildung von Radikalen möglich ist. Voraussetzung dafür ist eine homolytische Spaltung einer kovalenten Bindung. Dies geschieht beispielsweise beim Brom durch die Einwirkung von UV-Licht oder bei Benzoylperoxid durch thermische Einwirkung. Die anschließend entstandenen Startradikale nehmen entweder selbst an der Kettenfortplfanzung (Schritt 2) teil oder übertragen ihre Radikalfunktion an die Reatkionspartner.
Startreaktion
Startmolekül ist X2, welches homolytisch in zwei Halogenradikale gespalten wird:
Bei Raumtemperatur führt diese homolytische Spaltung für das Halogen Fluor zu einem sehr heftigen und sehr schnellen Reaktionsverlauf. Halogene wie Chlor oder Brom reagieren hingegen nur dann, wenn das Reaktionsgemisch belichtet wird (Photolyse). Iod lässt sich bei Raumtemperatur nicht spalten.
Kettenfortplanzung
Im Folgenden reagiert das Halogenradikal (in unserem Beispiel: X·) mit dem Kohlenwasserstoff (R–H) zum Halogenwasserstoff (H–X). Zusätzlich entsteht dabei ein Alkylradikal (R·):
Das aus der Reaktion hervorgehende Alkylradikal greift nun ein weiteres Halogenmolekül an und spaltet auch dieses homolytisch auf. Über eine Kohlenstoff-Halogenbindung bindet das Alkylradikal an ein Halogenatom. Es entstehen daraus ein Halogenalkan und ein Halogenradikal:
Abbruchreaktion
Unter der Ausbildung einer kovalenten Bindung können sich zwei aufeinander treffende Radikale rekombinieren (wieder zusammenfügen/Grundzustand einnehmen). Tritt dies in Kraft, endet die Kettenreaktion. Es können zudem unerwünschte Nebenprodukte entstehen:
Beispiele
Radikalische Chlorierung
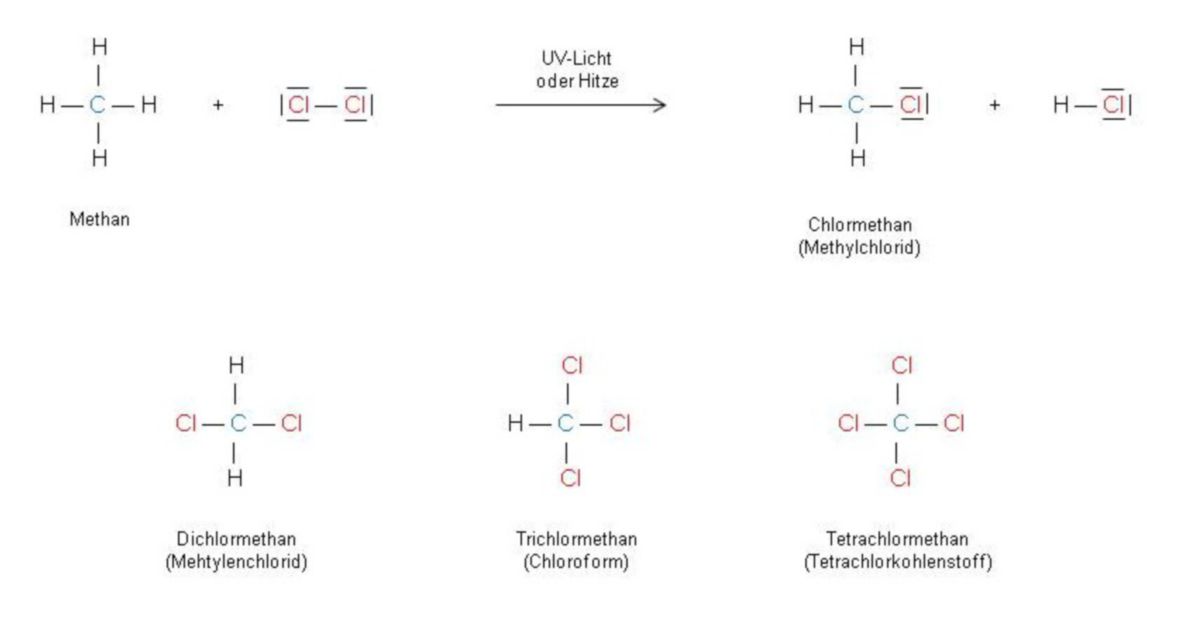
Chlor (Cl2) und Alkane sind nebeneinander beständig. Werden diese aber mit UV-Licht belichtet oder erhitzt, findet eine explosionsartige Umsetzung statt. Anschließend sind einfach und mehrfach chlorierte Kohlenwasserstoffe auffindbar. Ein H-Atom im Kohlenwasserstoff wird durch ein Chloratom ersetzt und es entsteht ein Chlorkalken. Es entsteht somit aus Methan zunächst Chlormethan (CH3Cl) und daraus über zwei zusätzliche Zwischenstufen schließlich das Tetrachlormethan (CCl4).
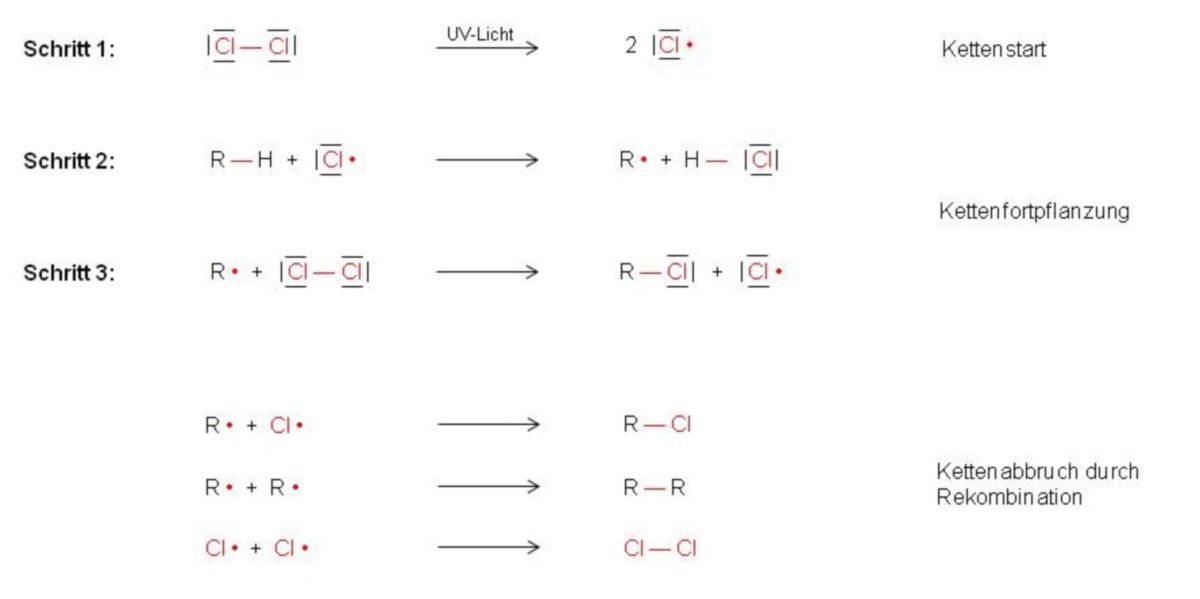
Unter dem Einfluss von UV-Licht dissoziieren einige Chlormoleküle (Cl2) durch homolytischen Bindungsbruch in einzelne Chloratome (Schritt 1). Diese sind als Radikale sehr reaktiv. Folglich greift ein Chlorradikal das Kohlenwasserstoffmolekül an, entreißt ihm ein H-Atom und bildet daraus den stabilen Chlorwasserstoff (HCl) sowie ein Alkylradikal (Schritt 2). Das Alkylradikal ist somit in der Lage, mit einem weiteren Chlormolekül (Cl2) zu reagieren. Es bindet ein Chloratom, das zweite Chloratom wird als Radikal freigesetzt (Schritt 3).
Ein einmal gebildetes Chlorradikal ist in der Lage, die Bildung vieler Chloralkanmoleküle zu bewirken. Schritte 2 und 3 ermöglichen, dass das Cl-Radikal stets wieder regeneriert. Deshalb werden diese Schritte als Kettenfortpflanzung bezeichnet, da sie für ein Fortlaufen der Reaktion sorgen. Wenn sich zwei Radikale miteinander verbinden, tritt jedoch ein Kettenabbruch ein. In der obigen Abbildung und somit in unserem Beispiel gibt es hierfür drei Möglichkeiten.
Aktivierungsenergie
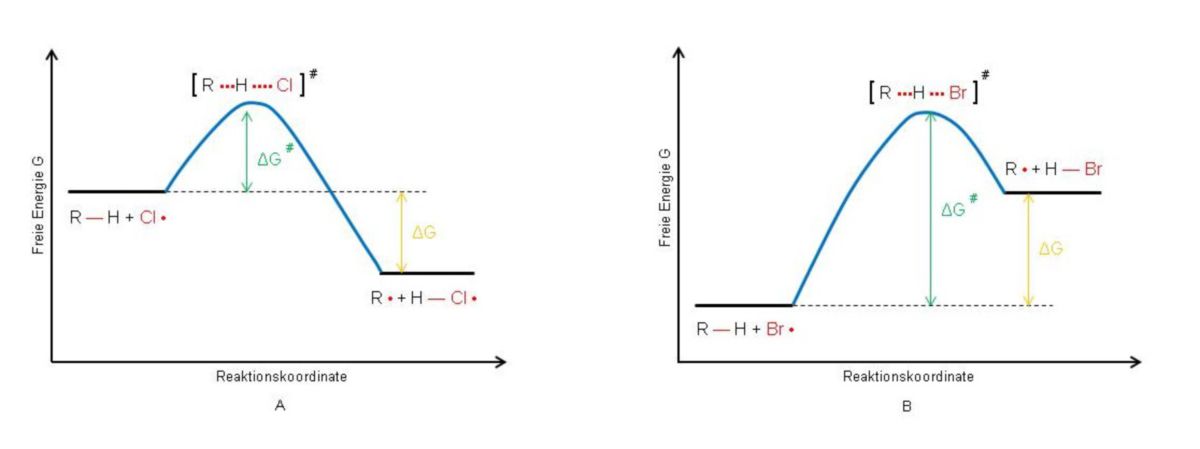
Ähnlich wie Chlor reagieren auch andere Halogene mit Alkanen. Für die Halogene Fluor, Chlor, Brom und Iod läuft die radikalische Substitution jedoch jeweils unterschiedlich ab. Ein besseres Verständnis dafür schafft ein Energiediagramm für den 2. Schritt der radikalischen Substitution (untere Abbildung). Die Ordinate bildet die Gibbs-Energie G, die Abszisse wird als Reaktionskoordinate bezeichnet und meint das Fortschreiten einer Reaktion im zeitlichen Nacheinander. Für den Schritt 2 der Alkanchlorierung gibt die Reaktionskoordinate an, wie weit die H–Cl-Bindung ausgebildet/fortgeschritten ist.
Die Ausgangsverbindungen (Edukte) und die Resultate (Produkte) unterscheiden sich im Energiehaushalt (ΔG < 0). Die Reaktion wird während des Ablaufens einen energiereichen Übergangszustand (ÜZ) durchlaufen. Dabei wird die R–H-Bindung teilweise gelöst und die H–Cl-Bindung teilweise ausgebildet. Um den Übergangszustand erreichen zu können, muss Energie eingesetzt werden. Diese wird als Gibbs-Aktivierungsenergie ΔG# bezeichnet.
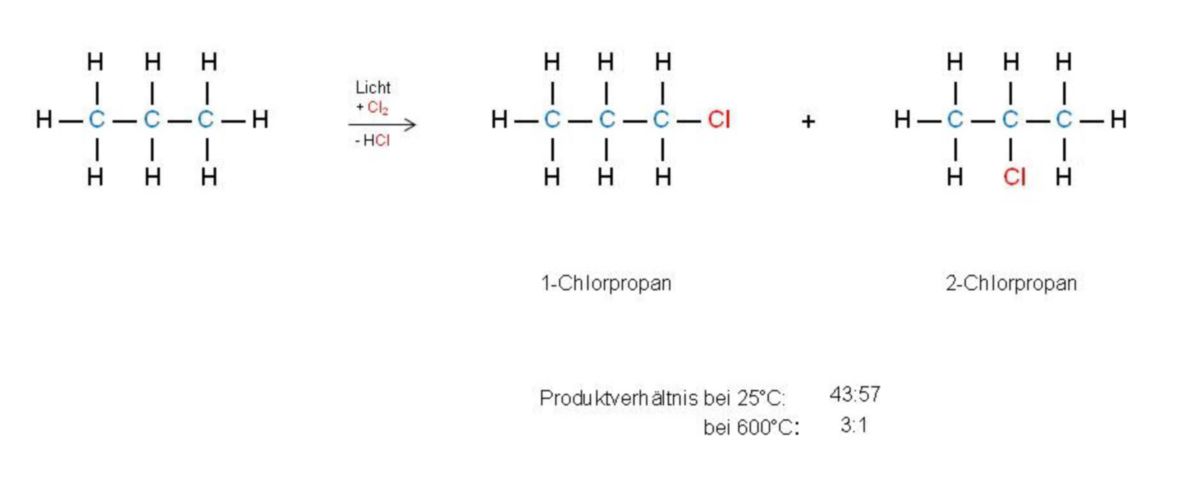
Bezieht man sich auf die radikalische Chlorierung von Alkanen, so ist die Aktivierungsenergie ΔG# für die Bildung verschiedener Radikale sehr ähnlich. Der statistische Effekt über das Produktverhältnis bei der Erstchlorierung entscheidet vorab bei der Reaktion von Propan (C3H8 zu Chlorpropan (C3H7Cl).
Propan besitzt sechs H-Atome an primären C-Atomen und zwei an einem sekundären. Dadurch bildet sich etwa dreimal mehr 1-Chlorpropan als 2-Chlorpropan. Will man dieses Produktverhältnis erreichen, muss dies bei 600 °C geschehen. Liegt jedoch Raumtemperatur vor, so entsteht mehr 2-Chlorpropan, da die Reaktivität der H-Atome am sekundären C-Atom etwas größer ist als an den primären C-Atomen. Somit erfolgt dort die Radikalbildung leichter. Jedoch ist die Selektivität der Produktbildung nicht sehr hoch.
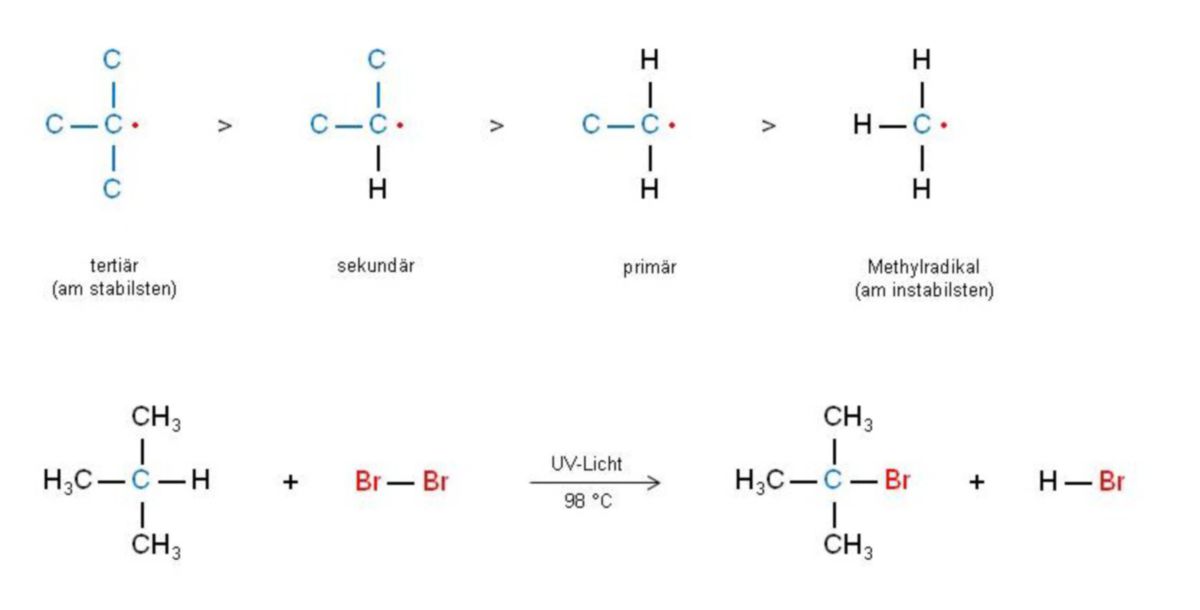
Bei der radikalischen Bromierung von Alkanen ist der 2. Schritt stark endergon, da die gebildete H–Br-Bindung schwächer als die gelöste C–H-Bindung ist und die freie Aktivierungsenergie ΔG# wesentlich zunimmt. Das Resultat ist, dass Unterschiede bei der Bildung verschiedener Alkylradikale, die bei Schritt 2 entstehen, deutlich hervortreten. Gibt es H-Atome an verschiedenen C-Atomen, so bilden sich bevorzugt die stabileren tertiären Radikale, gefolgt von sekundären, primären bzw. Methylradikalen. Somit substituiert ein Bromatom selektiv zuerst H-Atome an tertiären Kohlenstoffatomen. Aus einem Isobutan ensteht 2-Brom-2-methylpropan (tert-Butylbromid).
Radikalfänger
Da eine Radikalbildung durch ein Iodatom enstsprechend Schritt 2 der Kettenreatkion energetisch so ungünstig ist, gibt es keine radikalische Iodierung. Somit kann Iod als Radikalfänger auftreten. Im folgenden Beispiel wird ein Chloratom eingefangen. Es gilt: einmal entstandene Iod-Atome können nur rekombinieren. Jedoch gibt es andere Wege, Iodalkane herzustellen.
Iod als Radikalfänger:
Medizinische Bedeutung
- Chlorethan (C2H5Cl, Siedepunkt bei 12 °C) dient als Vereisungsmittel bei Sportverletzungen oder kleinen chirurgischen Eingriffen
- Halothan (C2HBrClF3, 2-Brom-2-chlor-1,1,1-trifluorethan, Siedepunkt bei 50 °C) wirkt bei 0,5 Vol.-% in der Atemluft stark narkotisch und wurde bis vor kurzem als Inhalationsnarkotikum verwendet. Der Nachteil liegt jedoch darin, dass bis zu 20% des eingeatmeten Halothans resorbiert werden und in der Leber metabolisiert wird. Es entstehen dabei um Teil sehr reaktive Abbauprodukte, die unter ungünstigen Umständen zu einem akuten Leberversagen führen können. Aufgrund dieser Problematik wird Halothan nur noch selten angewandt.
- Lipidperoxidation