Nukleosom
von lateinisch: nucleus - Kern; altgriechisch: soma - Körper
Synonym: Histon-DNA-Partikel
Englisch: nucleosome
Definition
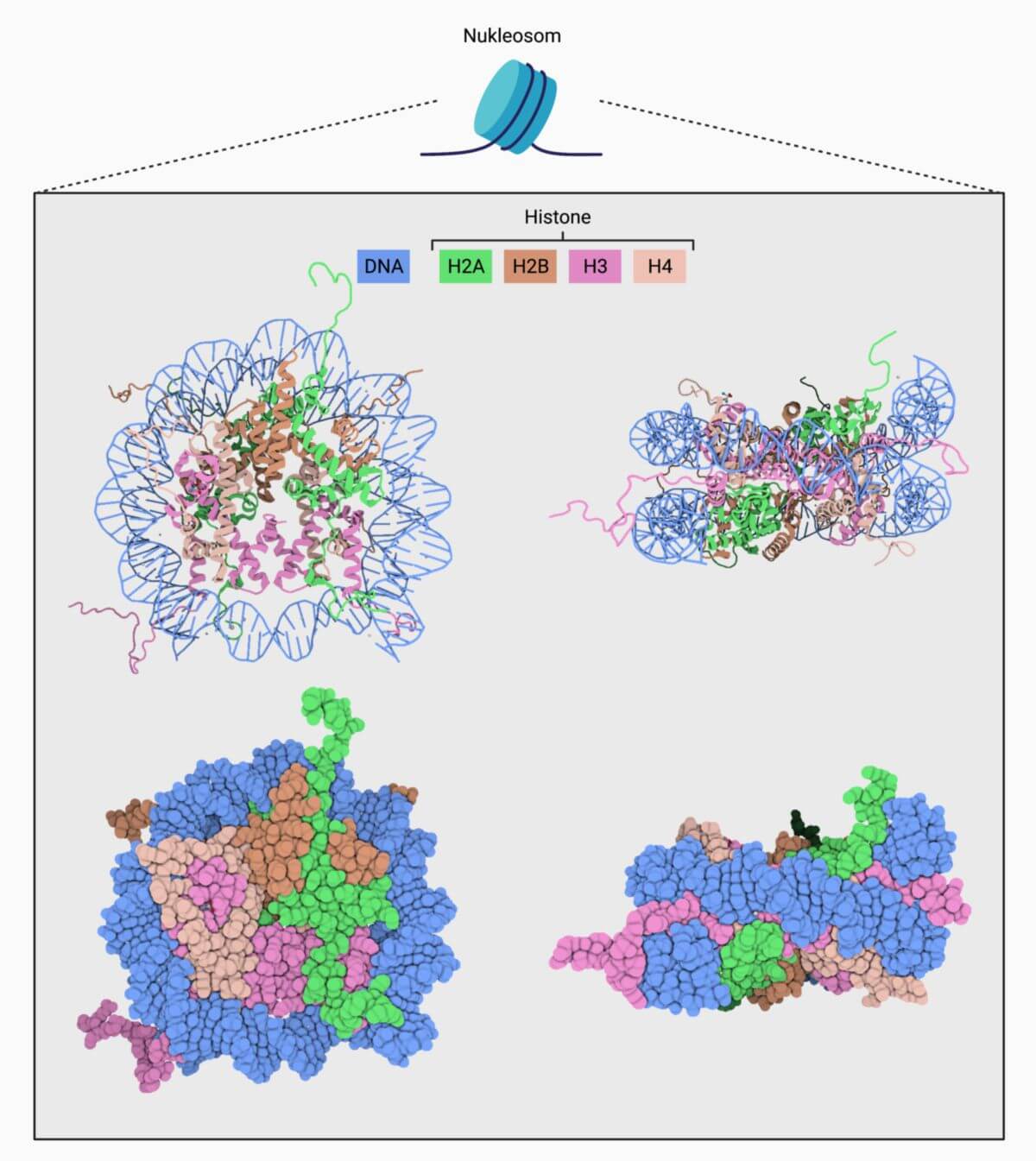
Unter dem Nukleosom versteht man die Einheit aus dem Histonproteinkomplex und der darum gewundenen DNA.
Hintergrund
In allen Eukaryoten liegt die DNA in einem kondensierten Zustand vor, der als Chromatin bezeichnet wird. Die Chromatinstruktur ähnelt unter dem Elektronenmikroskop einer Perlenkette, da die DNA in regelmäßigen Abständen um Proteinkomplexe aus Histonen gewickelt ist. Diese Einheiten werden als Nukleosomen bezeichnet.
Durch die Windung der DNA um den Histonkern kommt es insgesamt zu einer etwa 7-fachen Kondensation der DNA.
Struktur
Der Histonkern ist ein Oktamer aus je zwei Kopien der vier Kernhistone H2A, H2B, H3 und H4. Die Histone H3 und H4 bilden ein symmetrisches Heterotetramer. Mit diesem (H3-H4)2-Tetramer interagieren jeweils zwei H2A-H2B-Dimere. Die Kernhistone fügen sich zu einer spulenartigen Struktur zusammen, auf welche die DNA in etwa 1,75 linksdrehenden superhelikalen Windungen gewickelt ist. Diese Interaktion wird durch die Wechselwirkung zwischen negativ-geladenem DNA-Rückgrat und positiven Aminosäureresten (z.B. Lysin und Arginin) stabilisiert.
Die einzelnen Nukleosomen sind durch das Verbindungshiston H1 miteinander verbunden. Dieses ist für die höherrangige Kondensation zu Chromatinfasern erforderlich.
Die Wechselwirkungen zwischen den Kernhistonen machen das Nukleosom sehr stabil, aber nicht statisch. Vielmehr sind Nukleosomen in Bezug auf ihre Konformation dynamisch.
Interaktionen
Als Hauptträger epigenetischer Markierungen interagieren Nukleosomen mit über hundert verschiedenen Proteinen, die wiederum die Struktur und Dynamik der Nukleosomen beeinflussen. Dazu gehören:
Funktion
Nukleosomen haben funktionelle Relevanz bei der Bildung von Heterochromatin, beim Gene silencing oder bei der Aufspiralisierung der zum Metaphasenchromosom im Rahmen der Mitose.
Der positiv-geladene N-terminale Schwanz der Histone unterliegt posttranslationalen Modifikationen (PTMs), die sich auf die Stabilität der Nukleosomen und auf die Affinität zur DNA auswirken. Mögliche Histon-Modifikationen sind Acetylierung, Methylierung und Phosphorylierung.
Klinische Relevanz
Nukleosomen werden beim Zelltod in den Blutkreislauf freigesetzt. Erhöhte Serum- und Plasmaspiegel sind bei verschiedenen Krebsarten nachweisbar. Dazu gehören Lungen-, Bauchspeicheldrüsen- und Darmkrebs sowie maligne hämatologische Erkrankungen. Bei gastrointestinalen Tumoren korreliert die Nukleosomenkonzentration mit dem Tumorstadium und dem Vorhandensein von Metastasen, bei anderen Tumorarten wurde jedoch keine Korrelation festgestellt. Während der Remission ist häufig ein starker Abfall der Nukleosomenkonzentration nachweisbar, sie könnte daher als Marker für die frühzeitige Abschätzung einer therapeutischen Wirksamkeit hilfreich sein.
Auch bei Autoimmunerkrankungen und in akuten Situationen wie Schlaganfall, Trauma und während einer Sepsis können erhöhte Nukleosomenlevel festgestellt werden.
Quellen
- Zhou et al. Nucleosome structure and dynamics are coming of age Nature structural & molecular biology 2019
- Cutter und Hayes A brief review of nucleosome structure FEBS letters 2015
- Kornberg und Lorch Primary Role of the Nucleosome Molecular cell 2020
- Holdenrieder et al. Clinical relevance of circulating nucleosomes in cancer Annals of the New York Academy of Sciences 2008