NADH-Dehydrogenase
Synonyme: NADH-Ubichinon-Oxidoreduktase, Komplex I
Definition
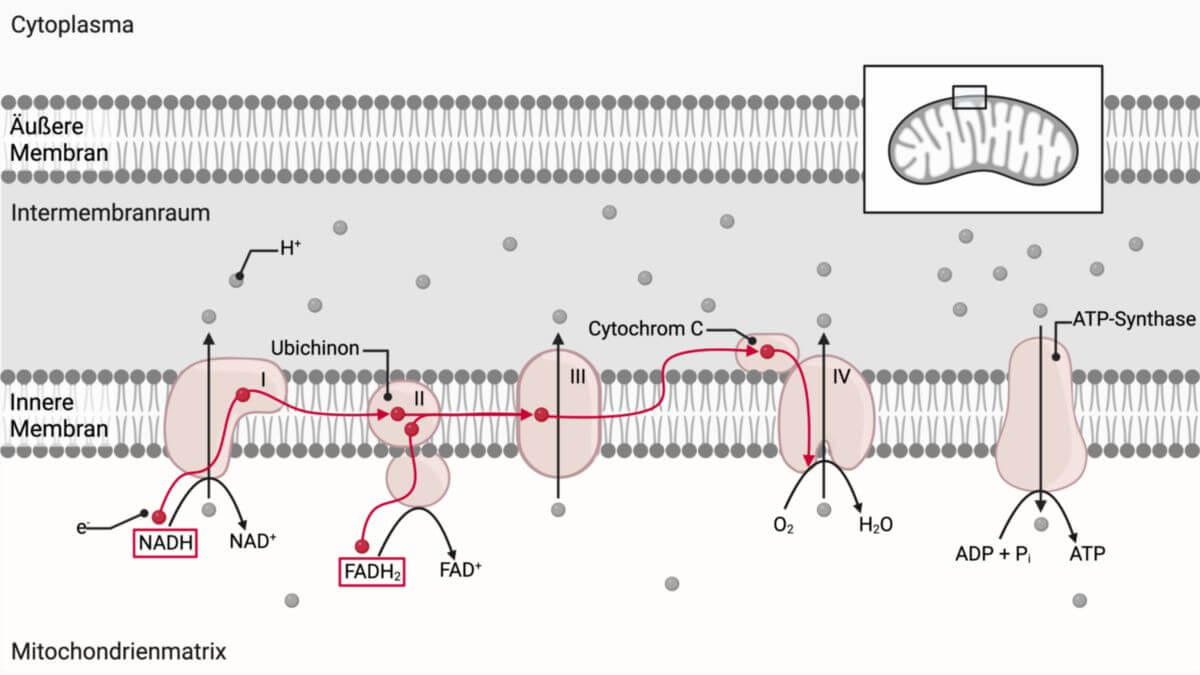
Bei der NADH-Dehydrogenase handelt es sich um ein Enzym, das Elektronen von NADH auf Ubichinon überträgt. Es schleust gleichzeitig 4 Protonen vom Matrixraum der Mitochondrien über die innere Mitochondrienmembran in den Intermembranraum. Es bildet den Komplex I der Atmungskette.
Hintergrund
Aufgabe der Atmungskette ist es, einen Protonengradienten im Mitochondrium aufzubauen und aufrecht zu erhalten, um anschließend durch die ATP-Synthase Energie in Form von ATP zu gewinnen.
Zur Atmungskette gehören u.a. eine Gruppe von Proteinkomplexen, die sog. Atmungskettenkomplexe I bis IV in der mitochondrialen Innenmembran, von denen die Komplexe I, III und IV in der Lage sind, als Protonenpumpen zu arbeiten und so unmittelbar zum Aufbau des Protonengradienten beitragen. Diese Protonenpumpen beziehen ihre Energie aus Elektronen, die in festgelegter Reihenfolge durch die verschiedenen Komponenten hindurchfließen und schließlich auf molekularen Sauerstoff (O2), der mit der Atemluft aufgenommen wird, übertragen werden.
siehe auch: Atmungskette
Aufbau
Die NADH-Dehydrogenase besteht aus 43 Polypeptidketten und ist ein außerordentlich großer Proteinkomplex von etwa 940 kDa mit einer L-förmigen Struktur. Der größte Teil besteht aus hydrophoben Proteinen und ist in die mitochondriale Innenmembran eingebettet. Der kleinere hydrophile Teil ragt in die Matrix der Mitochondrien hinein und dient der Aufnahme von Elektronen, die von NADH geliefert werden.
Das Enzym bindet als prosthetische Gruppen ein Flavinmononukleotid (FMN), das nichtkovalent, aber fest an das Enzym gebunden ist, und acht Eisen-Schwefel-Zentren. Die Eisen-Schwefel-Zentren lassen sich zwei unterschiedlichen Typen zuordnen, dem 2 Fe/2 S-Typ und dem 4 Fe/4 S-Typ. Bei beiden Typen sind die Eisenionen über Cystein mit den Untereinheiten des Komplex I verbunden.
Reaktion
NADH dient vor allem als Überträger für Elektronen aus dem Citratzyklus zur Atmungskette. Ein NADH-Molekül gibt zwei Elektronen an die hydrophile Untereinheit der NADH-Dehydrogenase ab. Die beiden Elektronen werden zunächst auf FMN übertragen, das zu FMNH2 reduziert wird. Vom FMNH2 werden die Elektronen an die Eisen-Schwefel-Zentren abgegeben. Auf diesem Weg springen sie von einem Eisen-Schwefel-Zentrum zum nächsten, wobei die Eisenionen dieser Zentren abwechselnd ein Elektron aufnehmen und abgeben und dabei zwischen dem Fe2+- und Fe3+-Zustand wechseln. Zuletzt werden die Elektronen auf Ubichinon (Coenzym Q) übertragen, das in der mitochondrialen Innenmembran frei löslich ist. Ubichinon dient zum einen der Übertragung von Elektronen auf Komplex III der Atmungskette, zum anderen der Übertragung von Protonen aus der Matrix in den Intermembranraum.
Hemmstoffe
Die NADH-Dehydrogenase wird durch Rotenon und Amobarbital gehemmt. Der Mechanismus ist eine Blockade des Elektronenflusses von den Eisen-Schwefel-Zentren auf das Ubichinon.
Klinik
Die Lebersche hereditäre Optikusneuropathie (LHON) ist eine seltene Erbkrankheit, bei der die Untereinheit 4 des hydrophoben Teils des Komplex I defekt ist. Der Defekt beruht in den meisten Fällen auf einer Punktmutation in der Position 11778 des mitochondrialen Genoms. Zwischen dem 20. und 30. Lebensjahr kommt es zu einer plötzlichen Degeneration der meisten Neurone des Nervus opticus und dadurch zur Erblindung.
Literatur
Joachim Rassow et al.: Duale Reihe Biochemie, Thieme Verlag, 2. Auflage