Ionenbindung
Synonym: ionische Bindung, heteropolare Bindung oder elektrovalente Bindung
Englisch: ionic bonding
Definition
Unter der Ionenbindung versteht man eine chemische Bindung, die auf der elektrostatischen Anziehung zweier Atome mit unterschiedlicher Elektronegativität basiert. Formuliert wurde sie 1916 vom deutschen Physiker Walter Kossel.
Hintergrund
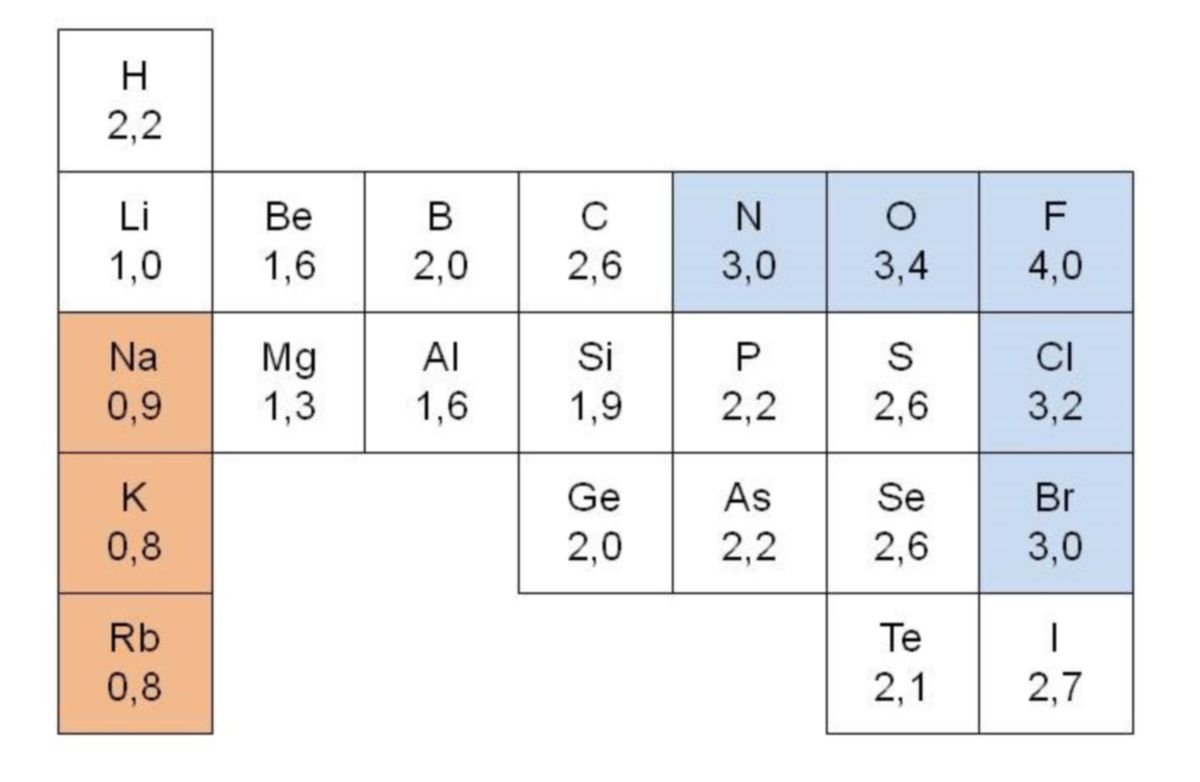
Bei der Ionenbindung handelt es sich um eine Bindung von zwei geladenen Atomen (Ionen). Dadurch entstehen Kation-Anion-Verbindungen. Der Übergang von einer Ionenbindung zu einer kovalenten Bindung ist fließend. Ab einer Elektronegativitätsdifferenz von ΔEN = 1,8 spricht man von einer Ionenbindung. Diese Grenze wurde willkürlich gezogen und als Übergang definiert. Unterhalb dieser Grenze spricht man von einer polaren Atombindung. Besteht keine Elektronegativitätsdifferenz, handelt es sich um eine rein kovalente Bindung.
Kationen
Weisen Atome eine geringe Anzahl an Valenzelektronen auf (Metalle), so haben diese Atome die Tendenz die äußersten Elektronen abzugeben. Die darunter liegende, somit also die äußerste Schale, befindet sich dann in Edelgaskonfiguration. Die Elektronenabgabe aus Atomen ist der Grund, wieso Kationen entstehen - positiv geladene Teilchen. Beispiel:
| Na+ = Natrium-Ion Mg2+ = Magnesium-Ion |
Ionisierungsenergie
Das Herauslösen eines Elektrons aus einem Atom geschieht nicht freiwillig. Es wird dazu Energie benötigt, die man als Ionisierungsenergie bezeichnet. Diese Energie nimmt innerhalb einer Periode von links nach rechts zu und innerhalb einer Hauptgruppe von oben nach unten ab (im Periodensystem der Elemente). In einer Periode haben die Edelgase die höchste Ionisierungsenergie.
Anionen
Fehlen Atome für die Edelgaskonfiguration ein oder zwei Valenzelektronen (1s2 bzw. s2p6) (Nichtmetalle), so haben diese eine Tendenz, die fehlenden Elektronen aufzunehmen. Die daraus entstehenden Teilchen weisen eine negative Ladung auf und werden deshalb als Anionen bezeichnet. Beispiele:
| F- = Fluorid-Ion O2- = Oxid-Ion |
Elektronenaffinität
Beim Vorgang im ersten Beispiel wird Energie frei, und zwar -382 kJ/mol. Im zweiten muss jedoch Energie aufgewendet werden (+704 kJ/mol). In beiden Fällen wird die Energie als Elektronenaffinität bezeichnet, wobei man stets auf das Vorzeichen achten muss:
- Energieabgabe: -
- Energieaufnahme: +
Bei den Elementen der Gruppe 15 bis 17 nimmt die Tendenz, dass Energie frei wird, von links nach rechts zu. Beim Sauerstoff muss beachtet werden, dass bei der Aufnahme des ersten Elektrons Energie frei wird (- 141 kJ/mol), das zweite verbraucht Energie, die ein Reaktionspartner aufbringen muss. Edelgase zeigen keine Neigung, Elektronen aufzunehmen. Grund dafür ist, dass diese schon Edelgaskonfiguration erreicht haben und somit die äußerste Schale (Valenzelektronen) vollständig aufgefüllt ist.
Neigung zur Ionenbildung
Elektronegativität
Nicht bei allen Elementen des Periodensystems ist die Neigung zur Bildung von Ionen, also die Aufnahme bzw. Abgabe von Elektronen, gleich ausgeprägt. Man kann eine deutliche Tendenz zur Bildung von Kationen bei den Elementen der 1. und 2. Hauptgruppe sowie bei den Nebengruppenelementen beobachten. Aus den Gruppen 16 und 17 bestehen bevorzugt Anionen. Die Abschätzung der Tendenz zur Ionenbildung wäre auf Grund der schwer messbaren Energiegrößen wie Ionisierungsenergie und Elektronenaffinität ein großer Aufwand, worauf man den Begriff Elektronegativität (EN) eingeführt hat. Dabei handelt es sich um eine relative Größe mit dimensionslosen Werten zwischen 0,7 und 4,0.
| Die Elektronegativität (EN) charakterisiert die Tendenz eines Atoms (gegenüber einem Parnter), Elektronen an sich zu ziehen. Die dazugehörenden Zahlenangaben für jedes Element sind als relative Größen dimensionslos anzusehen. |
|---|
Liegt eine hohe Elektronegativität vor, so bedeutet das, dass ein Atom zum Beispiel in einer Verbindung eine starke Tendenz hat, Elektronen an sich herüberzuziehen (Beispiel: F 4,0 oder O 3,4). Bewegt man sich innerhalb einer Periode (abgesehen von den Edelgasen), so nimmt die EN von links nach rechts zu, innerhalb einer Hauptgruppe von oben nach unten ab.
Eine gegenseitige Ionisierung der Atome bewirken Elemente, die sich in ihrer EN stark unterscheiden. Es entstehen somit Ionen und die daraus resultierenden Verbindungen, die man als Salze bezeichnet. Sind jedoch Atome mit ähnlicher EN vorhanden, so bilden diese untereinander Atombindungen aus. Es gibt zwischen diesen klar unterscheidbaren Prozessen Übergänge.
Salze
Elemente, die eine große Differenz in den Elektronegativitäten aufweisen, können sich zu Salzen verbinden. Sie haben eine starke Neigung zur Kristallisation und einen hohen Schmelzpunkt (z.B. NaCl: 801 °C). Ihre Schmelzen leiten den elektrischen Strom. Ionen sind bei den Leitungsvorgängen die Ladungsträger - im Gegensatz zu Metallen, bei denen Elektronen leiten.
Als Gitterenergie ΔHU bezeichnet man die Bindungsenergie eines Salzes. Beim NaCl beträgt diese 788 kJ/mol. Wenn sich Ionenkristalle bilden, wird diese Energie frei (negatives Vorzeichen). Die selbe Energie muss aufgewendet werden, wenn man das Ionengitter gegen die elektrostatische Anziehung in die einzelnen Ionen zerlegen will.
Gibt man metallisches Natrium und Chlorgas in einem Reaktionsgefäß zusammen, so tritt eine heftige Reaktion ein. Aus den Elementen geht eine farblose Verbindung hervor, das Natriumchlorid (auch bekannt als Kochsalz). Dieses Produkt weist völlig andere Eigenschaften auf als die zugrunde liegenden Elemente. Kochsalz setzt sich somit aus Natrium- und Chlorid-Ionen zusammen, die eine Ionenbindung eingehen. Aus der Schreibweise NaCl kann man nicht herausdeuten, dass die Substanz aus Ionen aufgebaut ist.
| Verbindungen, die im festen Zustand aus Ionen aufgebaut sind, nennt man Salze. |
|---|
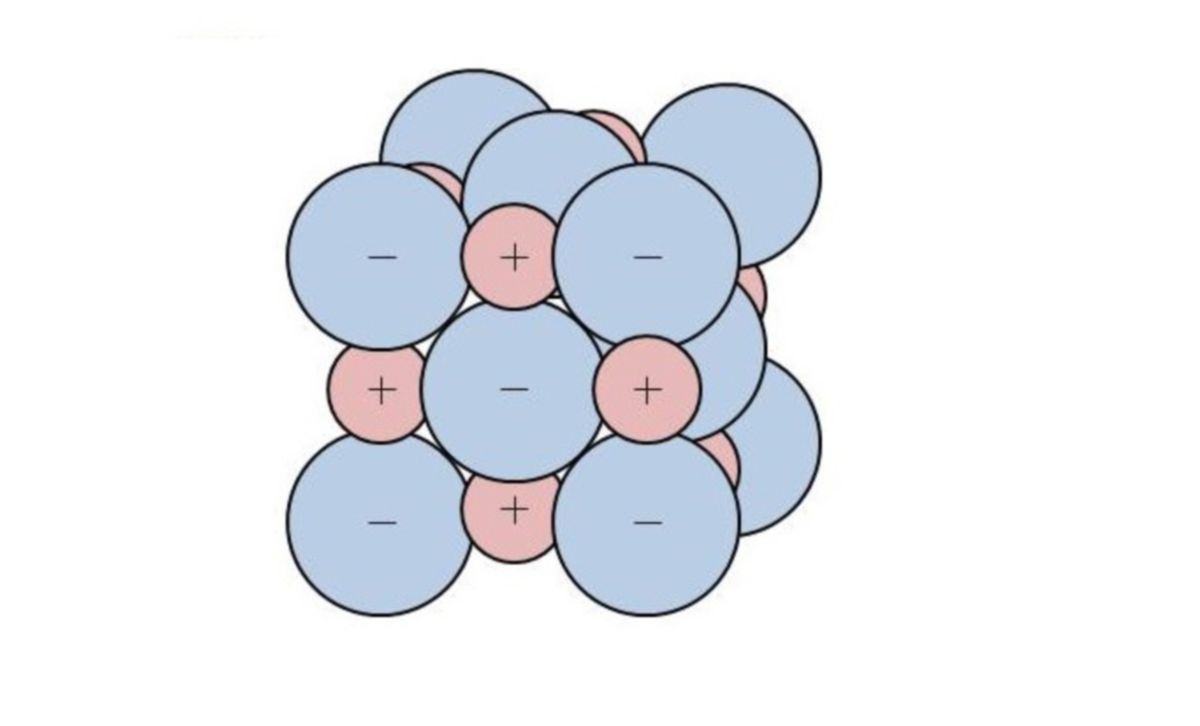
Ionengitter
Ionen bilden einen festen Ionenverband: Dreidimensional reihen sich Kationen und Anionen abwechselnd zu einem Ionengitter aneinander. Der Zusammenhalt zwischen den Teilchen erfolgt einzig und allein durch elektrostatische Anziehungskräfte. Die Ionenbindung ist außerdem ungerichtet.
| Anziehungskräfte, die für einen Zusammenhalt von gegensinnig geladenen Ionen sorgen, bezeichnet man als Ionenverbindung. |
|---|
Namen wichtiger Ionen/Salze
Die Ladung der Ionen können entsprechend der Stellung der Elemente im Periodensystem einfach oder mehrfach positiv bzw. negativ sein (Na+, Mg2+, Al3+ oder Cl-, S2-). Abhängig ist dies davon, wie viele Elektronen zum Erreichen der Edelgaskonfiguration abgegeben bzw. aufgenommen werden müssen. Die Ladung kann man rechts oben am Elementsymbol ablesen. Die Ladung entspricht bei einfachen Ionen zugleich der Wertigkeit bzw. Oxidationsstufe des betreffenden Elementes.
Will man Kationen benennen, muss man den Elementnamen durch den Zusatz "Ion" ergänzen. Es treten Ionen mit unterschiedlicher Wertigkeit auf (Fe2+, Fe3+), was man im Namen berücksichtigen muss.
Zur Benennung von Anionen bedarf es den Zusatz "Ion" eigentlich nicht, da die negative Ladung im Namen durch die Endsilbe "-id" oder "-at" ihren Ausdruck findet. Es gibt - wie schon erwähnt - einfache Anionen, aber häufig auch komplexe Anionen, die sich aus mehreren Atomen aufbauen und sowohl mineralischer wie auch organischer Natur sein können. Folglich noch die Formeln und Namen einiger wichtiger Ionen:
| Na+ K+ Mg2+ Ca2+ H+ Cu2+ Fe2+ Fe3+ Co2+ NH4+ |
Natrium-Ion Kalium-Ion Magnesium-Ion Calcium-Ion Wasserstoff-Ion (Proton) Kufper(II)-Ion Eisen(II)-Ion Eisen(III)-Ion Cobalt(II)-Ion Ammonium-Ion |
F- Cl- Br- I- OH- S2- SO42- NO3- PO43- HCO3- CH3COO- |
Fluorid Chlorid Bromid Iodid Hydroxid Sulfid Sulfat Nitrat Phosphat Hydrogencarbonat Acetat |
Die Formeln der Salze hängen unter anderem von der Zahl der beteiligten Ionen ab. Salze präsentieren sich nach außen hin neutral, was bedeutet, dass sich die positive und negative Ladung der Ionen ausgleichen müssen. Das Kennen der Ladung der beteiligten Ionen ist Voraussetzung für das Aufstellen von Salzformeln. Betrachtet man beispielsweise das Lithiumfluorid (LiF), so weiß man, dass sich hier einfach positive Li+ und einfach negative F- Ionen zusammenlagern. Beim Calciumfluorid hingegen benötigt ein Ca2+-Ion zwei F--Ionen zum Ladungsausgleich, um zur Formel CaF2 zu gelangen. Zerlegt man das Kaliumphosphat, so erhält man drei Kationen (K+), die die Ladung des Anions (PO43-) ausgleichen. Die vollständige Formel lautet K3PO4.
Charakteristische Eigenschaften
- Hoher Schmelz- und Siedepunkt. Grund dafür ist, dass in Kristallen durch die ungerichteten Bindungskräfte ein relativ stabiler Verbund über den gesamten Kristall entsteht.
- Stromleitfähigkeit in der Schmelze oder in Lösung. Ionen übernehmen dabei den Ladungstransport. An den Elektroden werden sie entladen, wodurch die Salze häufig in ihre Elemente zersetzt werden. Ionenleiter werden daher auch oft Leiter 2. Ordnung genannt.
- Ionenverbindungen weisen Eigenschaften wie "hart" und "spröde" auf. Versucht man einen Kristall plastisch zu verformen, so zerspringt dieser im Normalfall. Grund dafür sind die im Kristall gleich geladenen Ionen die zueinander geschoben werden. Dadurch werden die Bindungen aufgelöst.
- Kristallbildung
- Ionenkristalle weisen oft keine Farbe auf (sind somit farblos), da die Valenzelektronen meist stark gebunden sind und nur durch Photonen höherer Energie als der des sichtbaren Lichtes angeregt werden können.
- In wässriger Lösung dissoziieren Salze in ihre entsprechenden Ionen. Im Wasser lösen sich Ionenverbindungen - allerdings in unterschiedlichem Maße. Natriumchlorid ist beispielsweise in Wasser sehr gut löslich, Silberchlorid ist hingegen nahezu unlöslich.