δ-Aminolävulinatsynthase
Synonyme: δ-Aminolävulinatsynthase, δ-Aminolävulinsäuresynthase, δ-ALAS, 5-Aminolävulinatsynthase
Englisch: aminolevulinic acid synthase
Definition
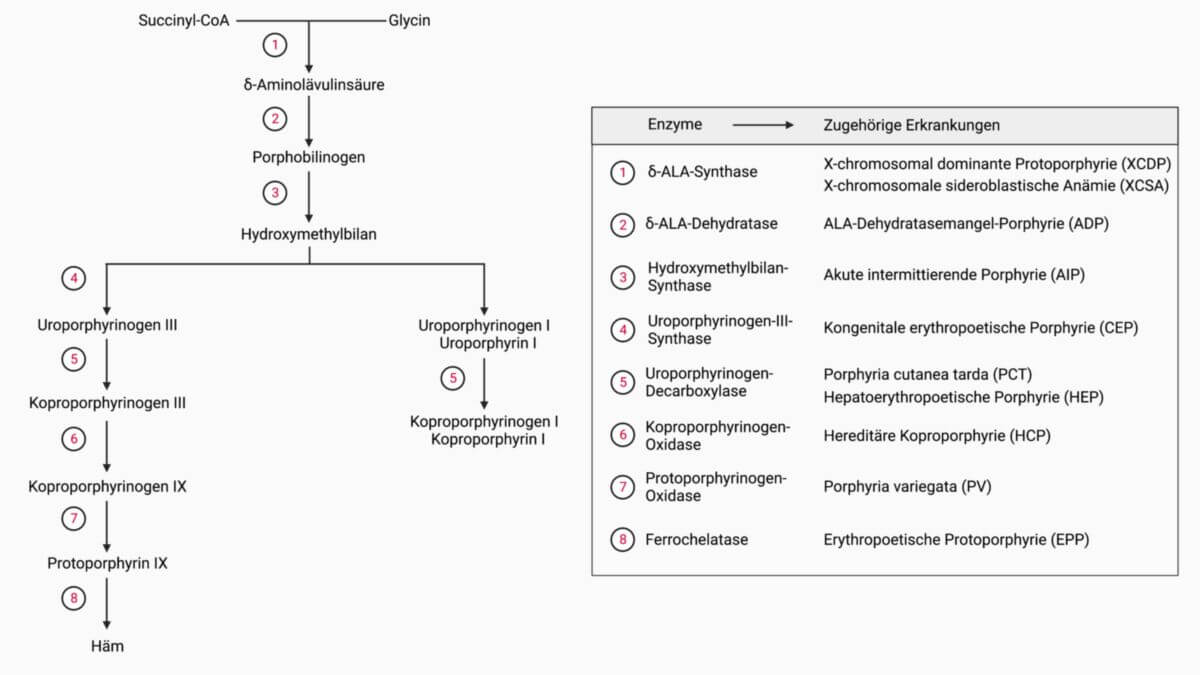
Die δ-Aminolävulinatsynthase, kurz δ-ALAS, ist ein mitochondriales Enzym aus der EC-Klasse 2 (Transferasen). Sie katalyisert den geschwindigkeitsbestimmenden Schritt der Porphyrinbiosynthese, also z.B. die Synthese von Häm.
Einteilung
Es existieren zwei Isoformen der δ-ALAS, die als δ-ALAS-1 und -2 bezeichnet werden. Die δ-ALAS-1 wird in allen nicht-erythroiden Geweben (insbesondere in der Leber) gebildet. Dagegen wird δ-ALAS-2 ausschließlich in Erythroblasten exprimiert.
Genetik
δ-ALAS-1 wird durch das ALAS-1-Gen auf Chromsom 3 am Genlokus 3p21 kodiert. Das ALAS2-Gen ist hingegen auf dem X-Chromosom am Genlokus Xp11.21 lokalisiert.
Katalysierte Reaktion
Der erste Schritt der Porphyrinsynthese wird durch δ-ALAS mit Pyridoxalphosphat als Coenzym katalysiert. Succinyl-CoA reagiert mit Glycin unter Abspaltung von Coenzym A zu α-Amino-β-ketoadipat, das spontan zu δ-Aminolävulinsäure (δ-ALA) decarboxyliert.
Regulation
Regulation der nicht-erythrozytären δ-ALAS-1
Die Bildung der δ-Aminolävulinatsynthase 1 wird durch Häm, das Endprodukt ihres Stoffwechselweges, sowie durch Glucose inhibiert.[1] Dieser Mechanismus der Expressionskontrolle ist aufgrund der kurzen Halbwertszeit des Enzyms (30 bis 60 min) rasch effektiv. Außerdem hemmt Häm den mitochondrialen Import der δ-ALAS-1. Die δ-ALAS-1 ist durch diverse Substanzen bzw. unter verschiedenen Umständen induzierbar:
- Arzneistoffe, z.B. Barbiturate, Glukokortikoide, Kontrazeptiva
- Alkohol
- körperlicher Stress (z.B. Infekte, Operationen)
- Hungerperioden
Regulation der erythrozytären δ-ALAS-2
Die δ-Aminolävulinatsynthase 2 steht unter inhibitorischer Kontrolle durch den zellulären Eisenspiegel.[1] Das ist sinnvoll, da im letzten Schritt der Hämsynthese, der durch die Ferrochelatase katalysiert wird, Fe2+-Ionen eingebaut und damit verbraucht werden. Bei Eisenmangel bindet das Eisen-regulatorische Protein IRP an sogenannte IRE-Strukturen (iron responsive element) in nicht translatierten mRNA-Regionen (UTR) für diverse Moleküle, die den Eisenhaushalt betreffen. Bei Bindung des IRP an solche Regionen der mRNA für die δ-ALAS führt dies zu einem Translations-Stop. Damit wird die Hämsynthese gehemmt und der Eisenverbrauch gesenkt. Eine Induktion der δ-ALAS-2 kann durch Erythropoetin hervorgerufen werden.
Klinik
Die X-chromosomale sideroblastische Anämie und die X-chromosomal dominante Protoporphyrie werden durch Mutationen des ALAS2-Gens verursacht.