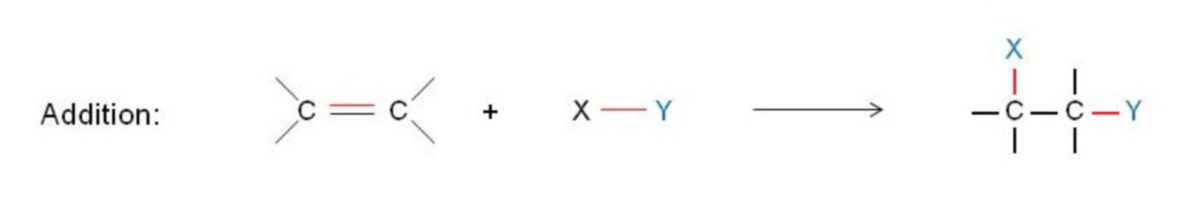Additionsreaktion
von lateinisch: addere - dazugeben
Synonyme: chemische Addition, Anlagerungsreaktion
Englisch: addition reaction
Definition
Die Additionsreaktion ist eine chemische Reaktion, bei der mindestens zwei Moleküle zu einem vereinigt werden, indem eine oder mehrere Mehrfachbindungen aufgespalten werden. Die Umkehrung einer Addition stellt die Eliminierung dar.
Hintergrund
Bei den Alkenen ist die π-Bindung der C=C-Doppelbindung für die Reaktivität der Alkene verantwortlich. Ihre bevorzugte Reaktion ist die Addition, d.h. ein Reagenz (X–Y) lagert sich unter Aufhebung der π-Bindung an die C-Atome der Doppelbindung an und überführt dabei die ungesättigte in eine gesättigte Verbindung.
Es werden eine σ-Bindung (Reagenz) und eine π-Bindung (Alken) gespalten. Durch die Additionsreaktion entstehen zwei neue σ-Bindungen (Produkt). Da die π-Bindung schwächer als die σ-Bindung ist, führt das zu einem Energiegewinn, der die Reaktion begünstigt.
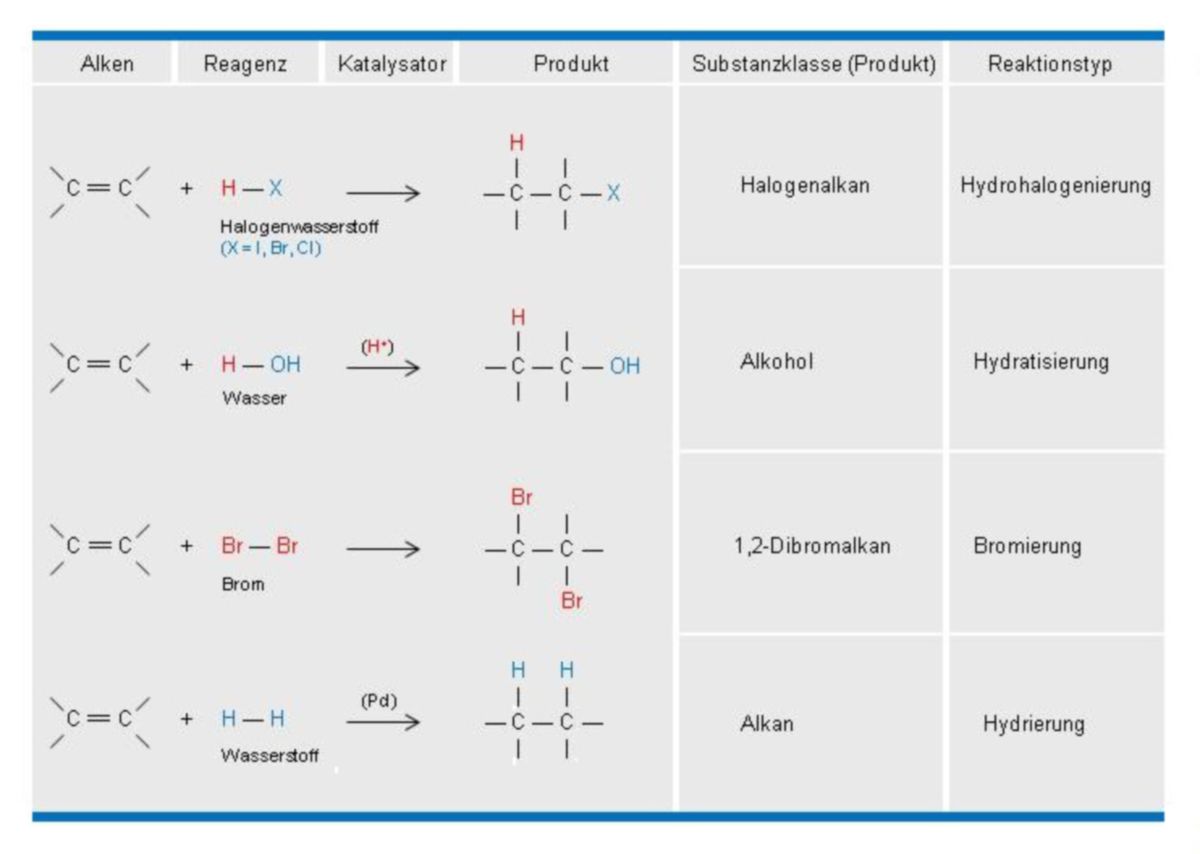
Die folgende Tabelle zeigt Beispiele für Additionsreaktionen an der C=C-Doppelbindung:
Beispiele
Addition von Chlorwasserstoff
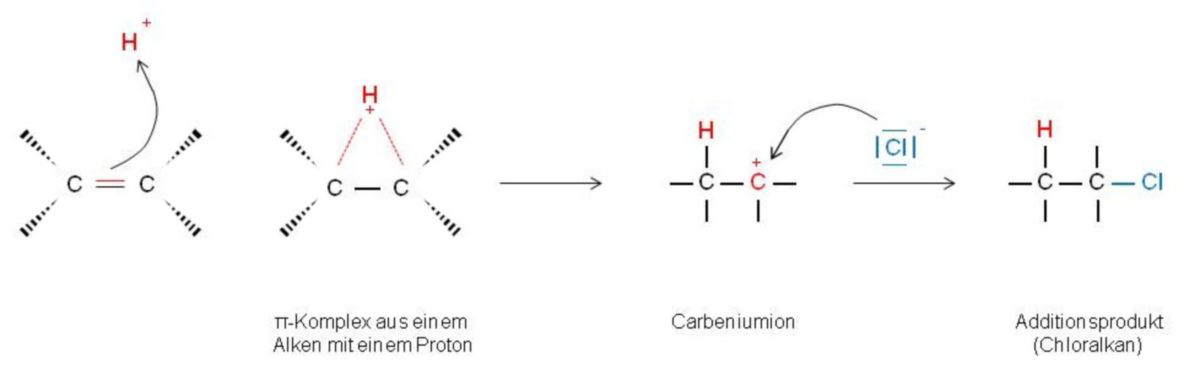
Ein Beispiel für Additionsreaktionen ist die Addition von Chlorwasserstoff (HCl) an Alkene. Auf Grund der Form der π-Orbitale im Alken ist die Elektronendichte in bestimmten Raumbezirken vergleichsweise hoch. Es besteht ein doppelt besetztes π-Orbital, das sich dem elektrophilen Reaktionspartner zuwendet und diesen locker an sich binden kann (π-Komplex). Zu Beginn der Addition (langsamer erster Schritt) werden die Elektronen der Doppelbindung dann für die neue Bindung zum Elektrophil zur Verfügung gestellt. Hierbei entsteht ein positiv geladenes Intermediat, ein Carbenium-Ion - so wird ein Molekül mit positiv geladenem C-Atom bezeichnet.
Chlorwasserstoff (HCl) dissoziiert in Wasser in Protonen und Chlorid-Ionen. Das Proton, welches das Elektrophil darstellt, wird kovalent an eines der beiden C-Atome gebunden. Folglich trägt das andere C-Atom nun die Elektronenlücke und die positive Ladung. Das protonierte Alken (Carbenium-Ion) ist auf dieser Stufe seinerseits ein Elektrophil. Es nimmt ein Elektronenpaar vom Nucleophil (Cl-) auf und bildet eine kovalente Bindung aus. Das daraus resultierende Additionsprodukt ist ein Chloralkan.
Addition von Wasser
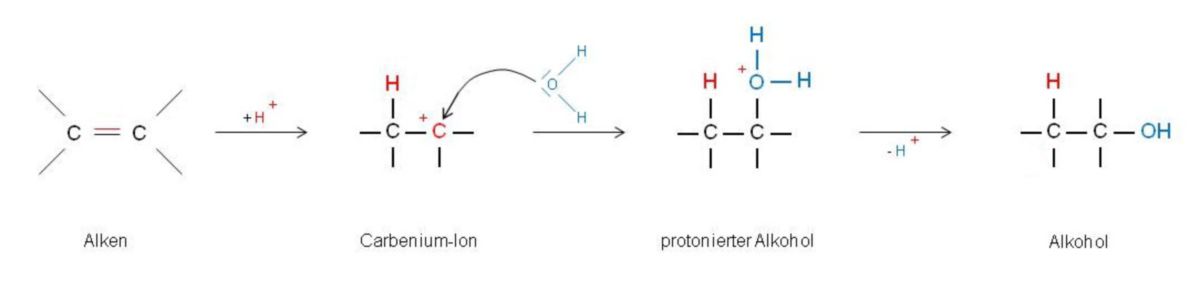
Als Hydratisierung bezeichnet man die Addition von Wasser an eine C=C-Doppelbindung. Biochemisch gesehen ist sie eine wichtige Additionsreaktion. Im Reagenzglas läuft eine solche Reaktion nicht freiwillig ab, da die Azidität des Wassers nicht ausreicht, um ein Alken zu protonieren. Wird aber eine geringe Menge eines Katalysators in Form einer starken Säure (z.B. Schwefelsäure) hinzugefügt, protonieren die freigesetzten Protonen einige Alken-Moleküle. Es bildet sich daraus ein Carbenium-Ion, das vom Nucleophil Wasser angegriffen wird. Direkte Folge hiervon ist die Bildung eines Alkohols. Bis zur Umsetzung aller Alkene kann die Reaktion fortgesetzt werden, da im ersten Schritt nicht alle Protonen verbraucht werden.
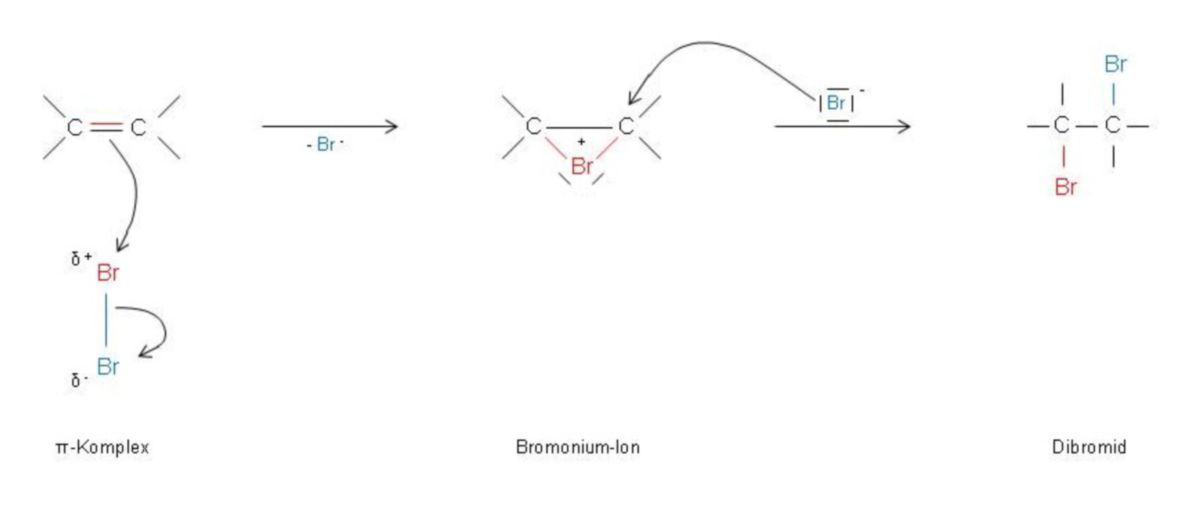
trans-Addition von Brom
Die Additon symmetrischer Reagenzien wie Brom (Br2) an eine C=C-Doppelbindung ist nach den oben angestellten Überlegungen zunächst weniger einleuchtend. Rotbraunes Brom reagiert jedoch in einem inerten Lösungsmittel (z.B. CH2Cl2, Dichlormethan) mit Alkenen sehr rasch zu farblosen 1,2-Dibromalkanen. Dieser Entfärbungsvorgang dient zum analytischen Nachweis von Alkenen.
Da das π-Elektron des Alkens auf das Brom-Molekül einwirkt, wird dieses polarisiert und heterolytisch gespalten. Br+ bildet gemeinsam mit den C-Atomen einen Dreiring aus, der als Bromomium-Ion bezeichnet wird. Von der Rückseite her greift Br- diesen Dreiring an einem der C-Atome nucleophil an und verdrängt das Br+ mit seinem Elektronenpaar von diesem C-Atom. Daraus resultiert das farblose Dibromid.
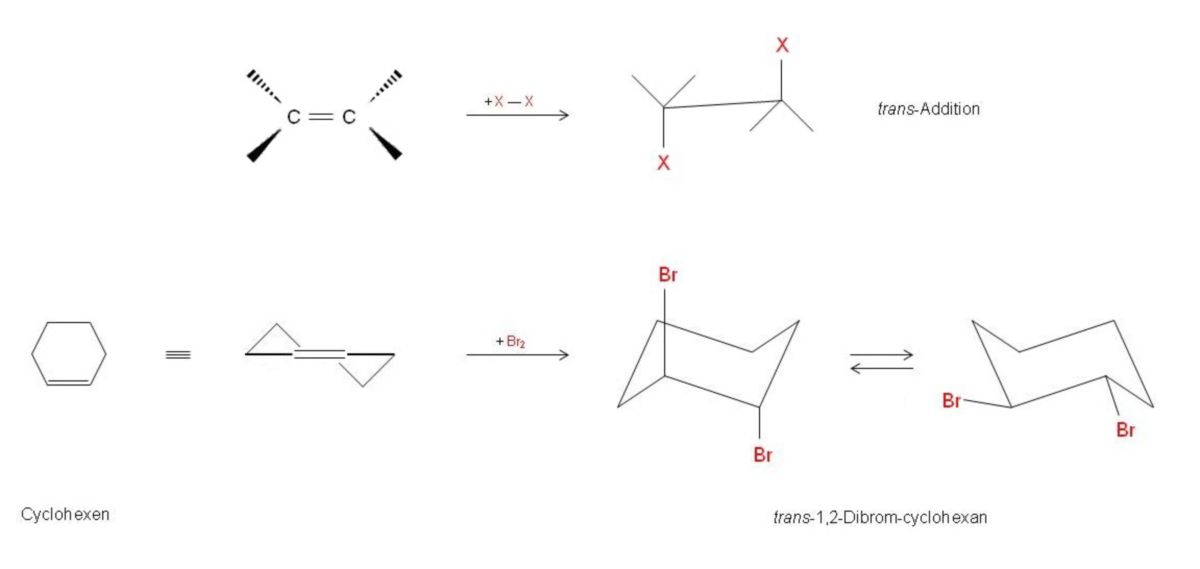
Die Brom-Addition ist deshalb eine trans-Addition, da die beiden eintretenden Brom-Substituenten räumlich gesehen von entgegengesetzten Seiten an die C-Atome andocken. Diese Situation spielt bei unsymmetrisch substituierten Alkenen und bei Cycloalkenen eine Rolle, weil von zwei der Addition denkbaren Isomeren nur eines entsteht; bezüglich des Cyclohexens das trans-1,2-Dibromcyclohexan. Ist die Addition abgeschlossen, stehen die Bromatome zunächst beide axial. Jedoch klappt der Cyclohexanring in das energieärmere Konformer (beide Bromatome äquatorial) um.
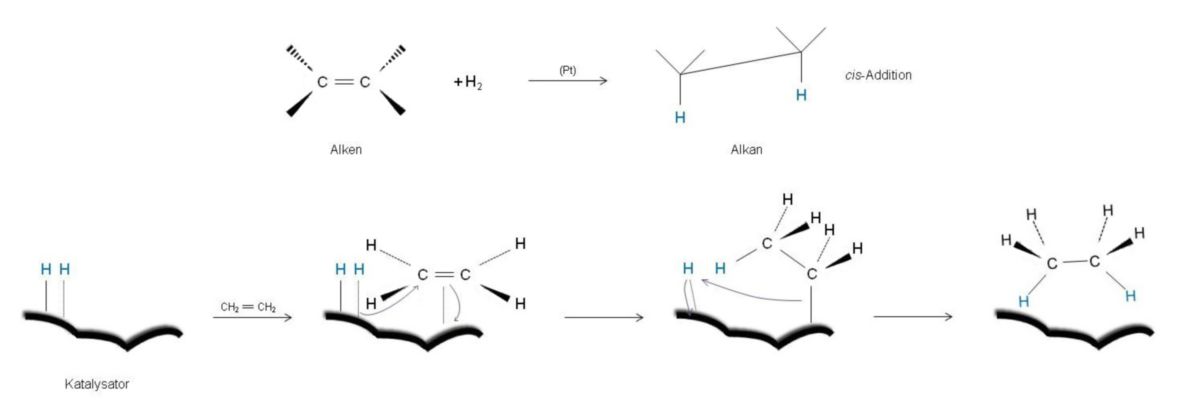
cis-Addition von Wasserstoff
Unter einer Hydrierung versteht man die Anlagerung von Wasserstoff (H2). Dieser Vorgang ist eine stark exotherme Reaktion, deren Reaktionsenthalpie ΔH0 man als Hydrierwärme bezeichnet.
Obwohl sie thermodynamisch gesehen günstig sind, laufen Hydrierungen nicht von alleine ab. Grund dafür ist, dass die erforderliche Gibbs-Aktivierungsenergie ΔG# zu groß ist. Als Katalysator verwendet man fein verteilte Edelmetalle, wie zum Beispiel Platin (Pt), Palladium (Pd) oder Nickel (Ni). Der Katalysator aktiviert den Wasserstoff. d.h. er wird unter Aufspaltung von H–H-Bindung auf der Metalloberfläche gebunden. Von der Oberfläche aus werden beide H-Atome auf derselben Seite der Doppelbindung angelagert. Diesen Vorgang nennt man cis-Addition. Man erhält so zum Beispiel aus 1,2-Dimethylcyclohexen das cis-1,2-Dimethylcyclohexan. Die Hydrierung verläuft an der Oberfläche des Katalysators umso schneller, je größer dessen Oberfläche ist.
Regioselektivität
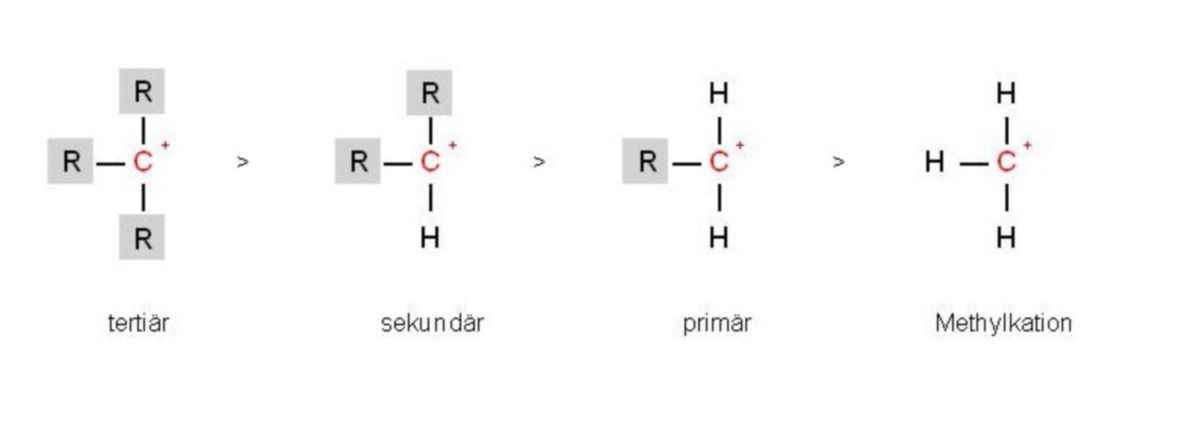
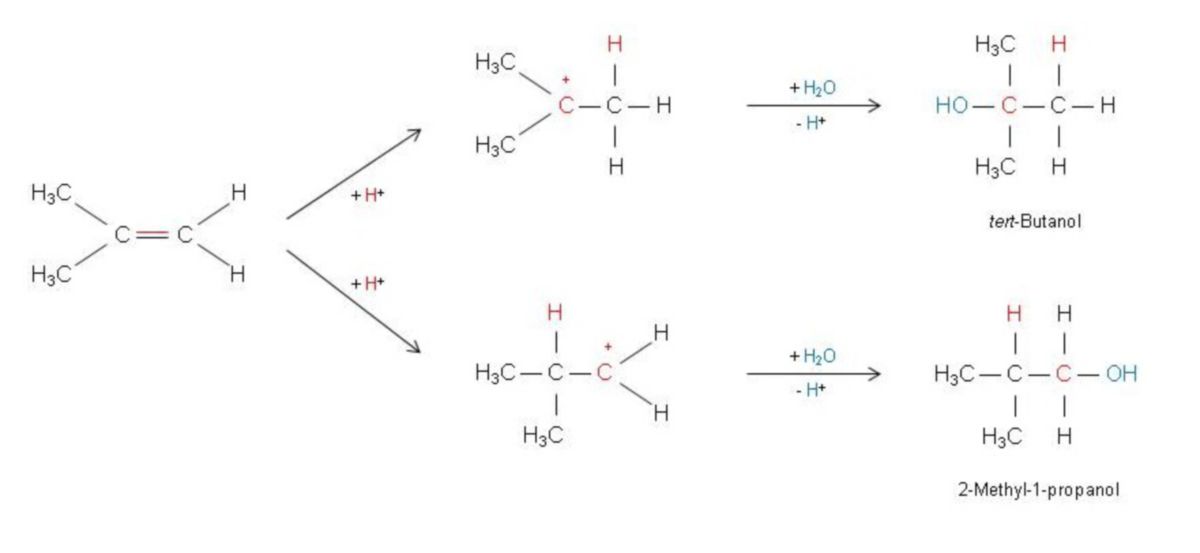
Liegen unsymmetrische Alkene vor, so sind zwei Richtungen für die Addition unsymmetrischer Reagenzien wie HCl oder H2O denkbar. Die bevorzugte Richtung hängt davon ab, welches der als Zwischenprodukt gebildeten Carbenium-Ionen energieärmer und damit stabiler ist.
Alkylreste stabilisieren an einem positiv geladenen C-Atom die Ladung besser als H-Atome. Die Folge ist, dass sich Kationen an tertiären C-Atomen leichter als an sekundären oder primären binden. Als Ursache dafür wird die leichtere Polarisierbarkeit der C–C- im Vergleich zur C–H-Bindung verantwortlich gemacht. Da das C-Atom mit der positiven Ladung einen Elektronenmangel aufweist, wird dieser teilweise dadurch ausgeglichen, dass die Bindungselektronen der C–C-Bindung stärker zu diesem C-Atom hingezogen werden (induktiver oder I-Effekt). Im unteren Beispiel (Abbildung) ensteht aus 2-Methyl-1-propen bevorzugt tert-Butanol. Anders ausgedrückt: Das Nucleophil greift (im zweiten Reaktionsschritt) das höher substituierte C-Atom an der Doppelbindung an (Markovnikov-Regel). Somit bezeichnet man Reaktionen, in denen von mehreren möglichen konstitutionsisomeren Produkten nur eines bevorzugt wird, als regioselektiv.