Natrium-Kalium-ATPase
Synonyme: Natrium-Kalium-Pumpe, Natrium-Kalium-Ionenpumpe, 3 Na+/2 K+-ATPase, Na-K-ATPase
Englisch: Na+/K+-ATPase, Na⁺/K⁺ pump, sodium-potassium pump
Definition
Die Natrium-Kalium-ATPase ist ein Enzym aus der Klasse der Transmembranproteine, das in der Zellmembran verankert ist. Es katalysiert unter Hydrolyse von Adenosintriphosphat (ATP) den aktiven Transport (d.h. gegen den Konzentrationsgradienten) von 3 Natriumionen aus der Zelle und 2 Kaliumionen in die Zelle und fungiert somit als Antiporter.
Struktur
Das Enzym besteht aus jeweils zwei α- und β-Untereinheiten, die gemeinsam als α2β2-Tetramer in der Membran liegen. Die α-Untereinheiten ragen größtenteils in das Zytosol, die β-Untereinheiten durchspannen die ganze Plasmamembran. Während der Enzymreifung dienen die β-Untereinheiten als Chaperone der α-Untereinheiten und überwachen die korrekte Faltung der mindestens acht transmembranären Domänen. Bindungsstellen präsentieren die α-Untereinheiten nach extrazellulär hin für Herzglykoside, nach intrazellulär für ATP.
Funktion
Pro Zyklus werden drei Na+-Ionen gegen den Konzentrationsgradienten aus der Zelle heraus und zwei K+-Ionen hineingepumpt. Effektiv handelt es sich um die Entfernung eines positiven Ladungsträgers aus dem Zytosol der Zelle pro Zyklus. Pro Sekunde kann dieser Zyklus bis zu 300-mal ablaufen.
In Nervenzellen werden etwa 50–70 % des gesamten Energieumsatzes für die Natrium-Kalium-Pumpe aufgewendet, in elektrisch inaktiven Zellen hingegen nur ca. 30 %.
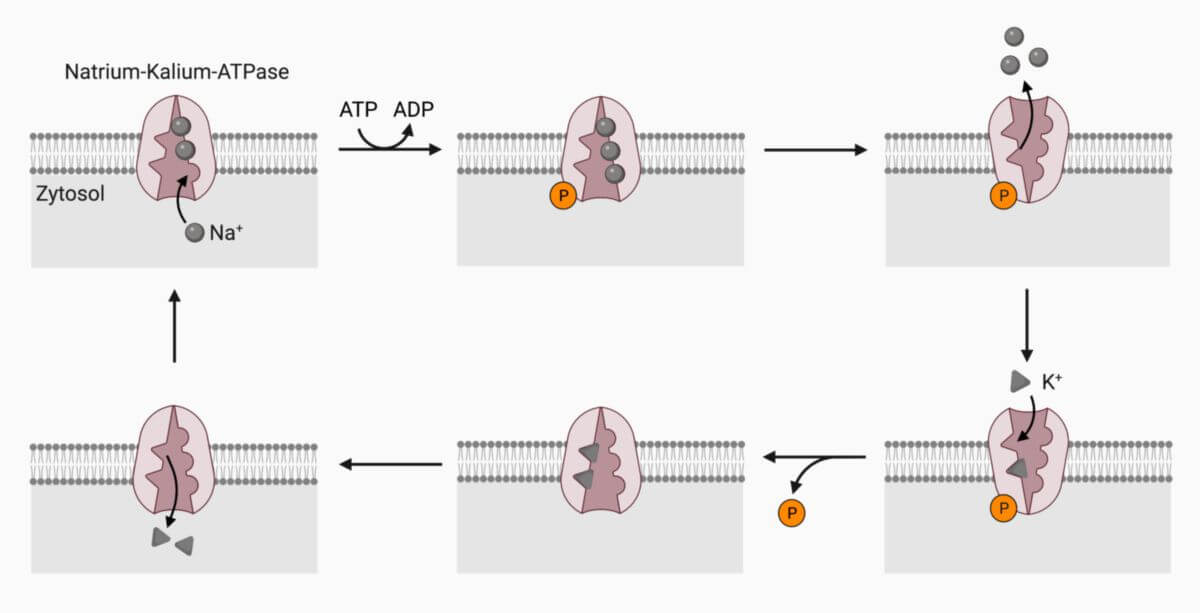
Zyklus
- Der Antiporter befindet sich im nach extrazellulär hin geschlossenen, aktivierbaren Zustand. Diese sogenannte Endoform besitzt hochaffine Bindungsstellen für drei Na+-Ionen.
- Unter Anwesenheit von intrazellulären Mg2+-Ionen diffundieren drei Na+-Ionen zu ihren zytosolischen Bindungsstellen der α-Untereinheit. Weiterhin wird ein Molekül ATP gebunden.
- Unter ATP-Verbrauch kommt es zur Autophosphorylierung eines Aspartatrests der α-Einheit. ADP wird dabei vom Phosphatrest abgespalten. Der Phosphatrest verbleibt in der Bindungsstelle.
- Die dabei frei gewordene Energie führt zu einer Konformationsänderung des Antiporters: Er ist nach intrazellulär geschlossen, nach extrazellulär offen. Diese sogenannte Exoform hat eine verminderte Affinität für Na+-Ionen und eine höhere Affinität für K+-Ionen.
- Die Na+-Ionen diffundieren aus den Bindungsstellen in den Extrazellularraum.
- Zwei K+-Ionen diffundieren an die passenden extrazellulären Bindungsstellen.
- Die Bindung führt zur Dephosphorylierung mit Konformationsänderung der Na-K-ATPase. Der Antiporter ist wieder nach Außen hin geschlossen und nach Innen hin geöffnet (Endoform).
- Die unphosphorylierte Pumpe hat eine geringere Affinität für K+-Ionen, weshalb diese den Antiporter in das Zytoplasma verlassen.
- Das Enzym steht wieder in seiner Ausgangsstellung bereit.
Pharmakologie
Hemmung
Die Natrium-Kalium-ATPase kann durch bestimmte Substanzen gehemmt werden, z.B. durch
- Herzglykoside (Digitalis)
- Ouabain
Eine Hemmung der Natrium-Kalium-Pumpe fördert die Entstehung einer Hyperkaliämie.
Stimulation
Umgekehrt kann pharmakologisch auch eine Stimulation der Pumpe erreicht werden, z.B. durch
Eine Stimulation der Natrium-Kalium-Pumpe fördert eine Hypokaliämie. Dies ist u.a. der Grund, warum bei der Therapie eines ketoazidotischen Komas die Insulingabe unter strikter Kontrolle des Serumkaliums erfolgen muss.
Merkhilfe
Als Merkhilfe dient zum Beispiel der Spruch "3 Nazis raus, 2 Kumpel rein".