Tirbanibulin
Handelsname: Klisyri®
Englisch: tirbanibulin
Definition
Tirbanibulin ist ein antiproliferativ wirkender Arzneistoff aus der Gruppe der Mikrotubuli-Inhibitoren bzw. Mitosehemmer. Er wird topisch zur Behandlung leichter aktinischer Keratosen eingesetzt.
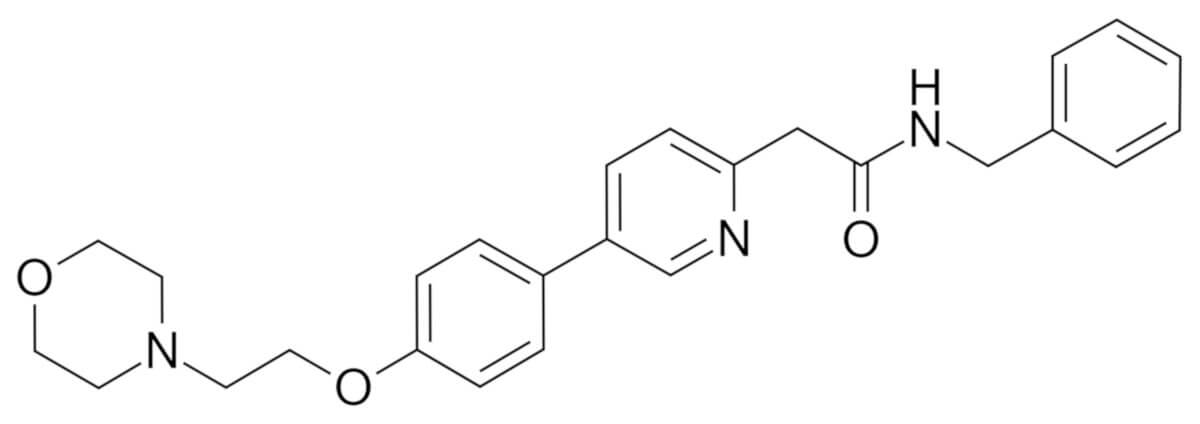
Chemie
Die chemische Bezeichnung von Tirbanibulin ist N-benzyl-2-(5-(4-(2-morpholinoethoxy)phenyl) pyridin-2-yl) acetamid. Die Summenformel lautet C26H29N3O3. Die molare Masse beträgt rund 431,5 g·mol−1.
Wirkmechanismus
Tirbanibulin schädigt die Mikrotubuli durch direkte Bindung an Tubulin. Ferner kommt es zu einer Unterbrechung des Signalwegs der Tyrosinkinase Src. Im Effekt resultiert daraus eine Unterbrechung des Zellzyklus und eine Apoptose pathologisch veränderter Hautzellen.[1]
Pharmakokinetik
Nach Anwendung auf der Haut wird Tirbanibulin minimal resorbiert. Die resultierenden Plasmakonzentrationen sind niedrig und liegen im Nanogramm-Bereich.[1]
Der Wirkstoff wird zum größten Teil von CYP3A4 metabolisiert und in geringerem Maße von CYP2C8. Die metabolischen Hauptwege sind Debenzylierung und Hydrolyse.
Indikationen
Tirbanibulin ist angezeigt für die Feldtherapie nicht-hyperkeratotischer, nicht-hypertropher aktinischer Keratosen (Olsen-Grad I) im Gesicht oder auf der Kopfhaut bei Erwachsenen.
Darreichungsform
Tirbanibulin ist als Salbe mit einem Wirkstoffgehalt von 10 mg Tirbanibulin je Gramm Salbe erhältlich. Die Salbe ist in Beuteln zur Einzelanwendung mit je 2,5 mg Tirbanibulin in 250 mg Salbe portioniert.
Dosierung
Tirbanibulin-Salbe wird über einen Behandlungszyklus von 5 aufeinanderfolgenden Tagen einmal täglich auf das Behandlungsareal im Gesicht oder auf der Kopfhaut aufgetragen werden. Die Salbe sollte in einer dünnen Schicht auf das Behandlungsareal von bis zu 25 cm2 appliziert werden.
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkungen
Sehr häufige (≥1/10) und häufige (≥1/100, <1/10) Nebenwirkungen von Tirbanibulin an der Applikationsstelle sind:[1]
- Erythem
- Exfoliation (Schuppenbildung und Schuppung)
- Schorf (Verkrustung)
- Schwellung
- Erosion (einschließlich Ulzeration)
- Schmerzen
- Pruritus
- Bläschen (einschließlich Pusteln)
Kontraindikationen
- Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile des Arzneimittels
Toxizität
In tierexperimentellen Studien wirkte Tirbanibulin bei einer 22-fach und 65-fach höheren Exposition als unter maximaler therapeutischer Anwendung beim Menschen embryo- und fetotoxisch. Während einer Schwangerschaft sollte Tirbanibulin deshalb nicht angewendet werden.[1]
Nutzenbewertung
Der G-BA kommt auf der Basis der vom IQWiG gesichteten Daten zu folgender Einschätzung:[2]
- Ein Zusatznutzen ist nicht belegt.
Kosten
Die Jahrestherapiekosten liegen in Deutschland bei rund 112 Euro.
Zulassung
Weblinks
- DocCheck News: Aktinische Keratose: Was kann Tirbanibulin?, abgerufen am 11.12.2024
Quellen
- ↑ 1,0 1,1 1,2 1,3 Klisyri, INN-Tirbanibulin - European Medicines Agency, abgerufen am 11.12.2024
- ↑ Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie: Anlage XII – Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a des Fünften Buches Sozialgesetzbuch (SGB V): Tirbanibulin (Aktinische Keratose, Olsen-Grad I), vom 17. Februar 2022, abgerufen am 11.12.2024