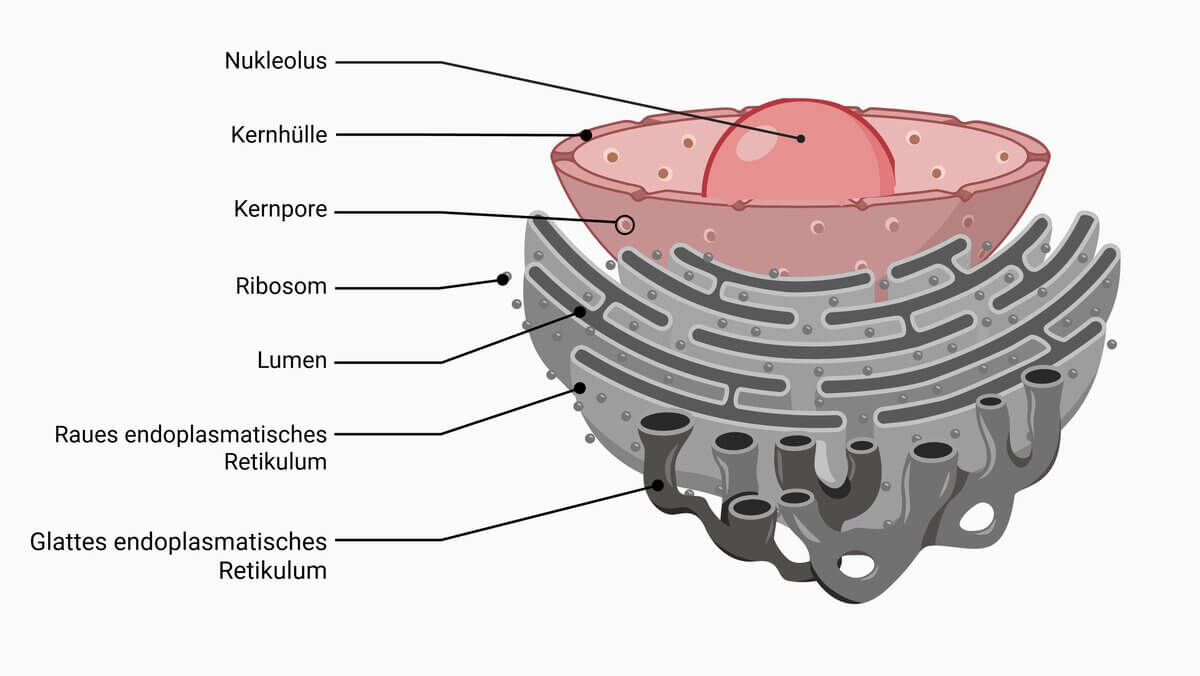
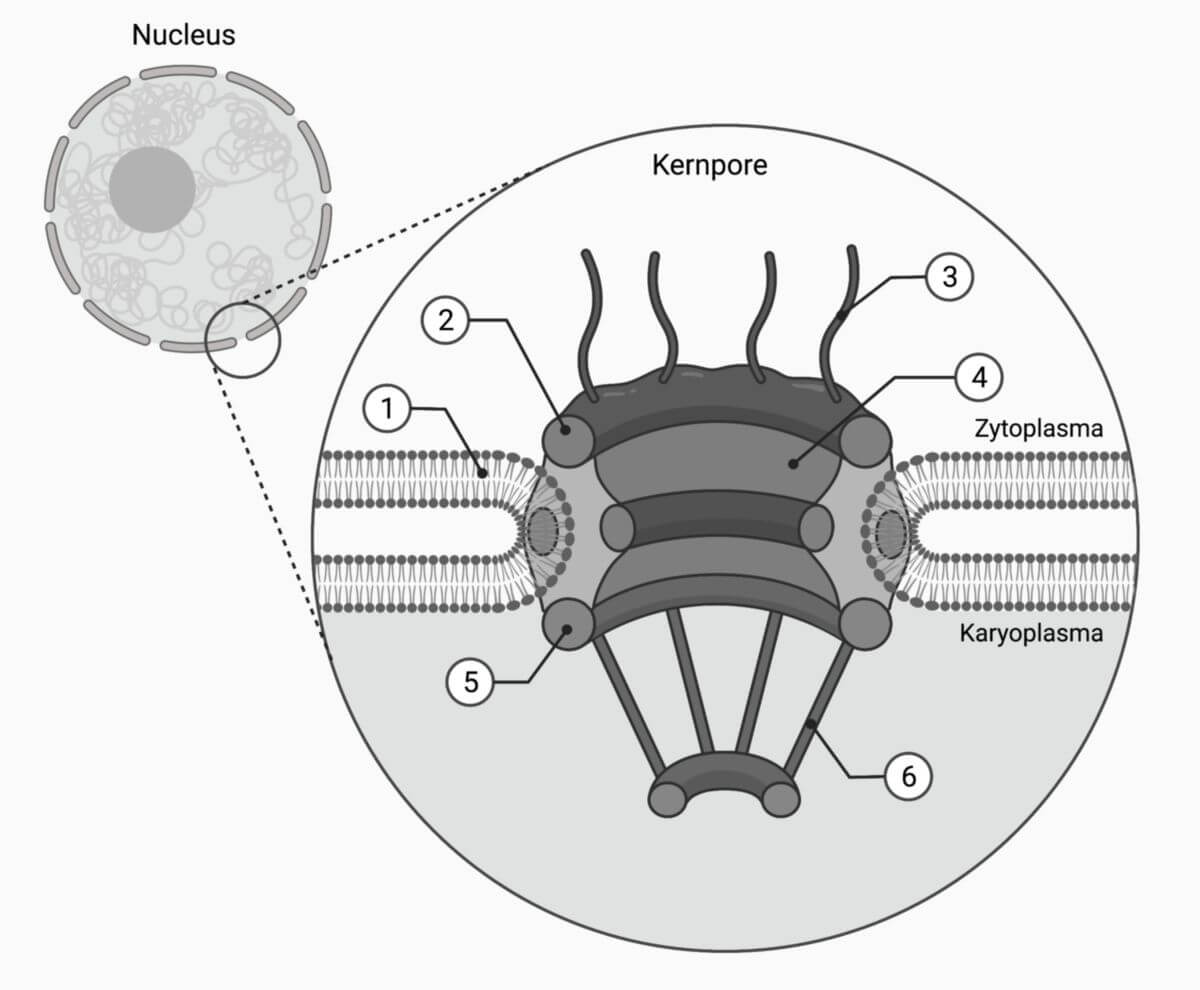
Kernpore
von lateinisch: porus - Öffnung
Synonym: Kernporenkomplex
Englisch: nuclear pore, nuclear pore complex, NPC
Definition
Kernporen sind Proteinkomplexe in der Kernmembran eukaryotischer Zellen. Sie sind aus über 30 verschiedenen Proteinen aufgebaut, den sogenannten Nukleoporinen. Über die Kernporen findet der nukleozytoplasmatische Transport von RNAs, Proteinen und anderen Makromolekülen statt.
Hintergrund
Kernporen fungieren als "Tore" für den Zellkern. Sie ermöglichen sowohl die passive Diffusion kleinerer Moleküle, als auch den spezifischen Transport größerer Moleküle. Exportiert werden dabei vorwiegend RNAs (z.B. mRNAs und tRNAs) sowie ribosomale Proteine. Importiert werden u.a. Proteine (z.B. DNA-Polymerasen und Lamine), Kohlenhydrate und Lipide. Die Richtung des Proteintransports wird durch spezifische Signalsequenzen gesteuert: Kernlokalisierungssignale (NLS für "nuclear localization signal") und nukleäre Exportsignale (NES). Diese werden durch Importine bzw. Exportine erkannt, die unterstützt durch das kleine G-Protein Ran den nukleozytoplasmatischen Transport bewerkstelligen.
Ein Zellkern kann mehrere tausend Kernporen enthalten, bei Wirbeltieren sind es ca. 2.000 Poren pro Zellkern. Die Anzahl variiert in Abhängigkeit vom Zelltyp, so enthalten Zellen mit hoher Transkriptionsrate mehr Kernporen.
Größe
Kernporen haben einen äußeren Durchmesser von ~ 120 nm, einen inneren Durchmesser von ~ 40 nm und eine Höhe von ~ 80 nm. Das durchschnittliche Molekulargewicht beträgt 110 MDa.
Aufbau
Eine Kernpore besteht aus rund 500 Proteinen. Dabei handelt es sich um verschiedene Nukleoporine, die jeweils in mehrfacher Kopie vorliegen. Sie sind in drei ringförmigen Strukturen übereinander angeordnet:
- zytoplasmatischer Ring (bzw. äußerer Ring)
- Zentralkanal
- nukleärer Ring (bzw. innerer Ring)
Jeder Ring weist eine achtfache Symmetrie auf. Darüber hinaus verfügen die Kernporen über zytoplasmatische Fasern und einen nukleären Korb ("nuclear basket").
Dem Inneren der Pore zugewandt befinden sich Nukleoporine, die zu den intrinsisch ungeordneten Proteinen zählen. Sie enthalten Cluster der Aminosäuren Phenylalanin (F) und Glycin (G). Diese "FG-Repeats" ragen in den Kanal hinein und bilden einen Filter, der die passive Diffusion großer Moleküle verhindert. Diese Moleküle werden an Karyopherine ("Kaps") gebunden, die ihre Beladung durch Interaktion mit den FG-Repeats durch die Kernpore schleusen können.
Die folgende Tabelle listet die wichtigsten Nukleoporine auf. Sie werden systematisch nach ihrer Molekülmasse benannt. "NUP35" hat demnach eine molekulare Masse von 35 kDa.
| Struktur | Proteine |
|---|---|
| Zytoplasmatischer Ring und Filamente | |
| Zentralkanal | |
| Nukleärer Ring und Korb |