EGF-Rezeptor
Synonyme: epidermaler Wachstumsfaktorrezeptor, ErbB1, HER1
Englisch: epidermal growth factor receptor
Definition
Der EGF-Rezeptor ist eine membranständige Rezeptortyrosinkinase, die zur Familie der ErbB-Membranrezeptoren gehört, und zuerst in den 1980er-Jahren durch Mendelsohn beschrieben wurde.
Liganden
Durch Assoziation mit einem von mehreren Liganden bildet der Rezeptor ein Homodimer bzw. ein Heterodimer mit anderen ErbB(2-4)-Rezeptoren. Dabei werden durch Autophosphorylierung von Tyrosinresten auf der zytosolischen Seite eine Reihe von Signalkaskaden angestoßen. Bisher sind mehrere Liganden mit einer Bindungsfähigkeit an EGF-Rezeptoren beschrieben, u.a.:
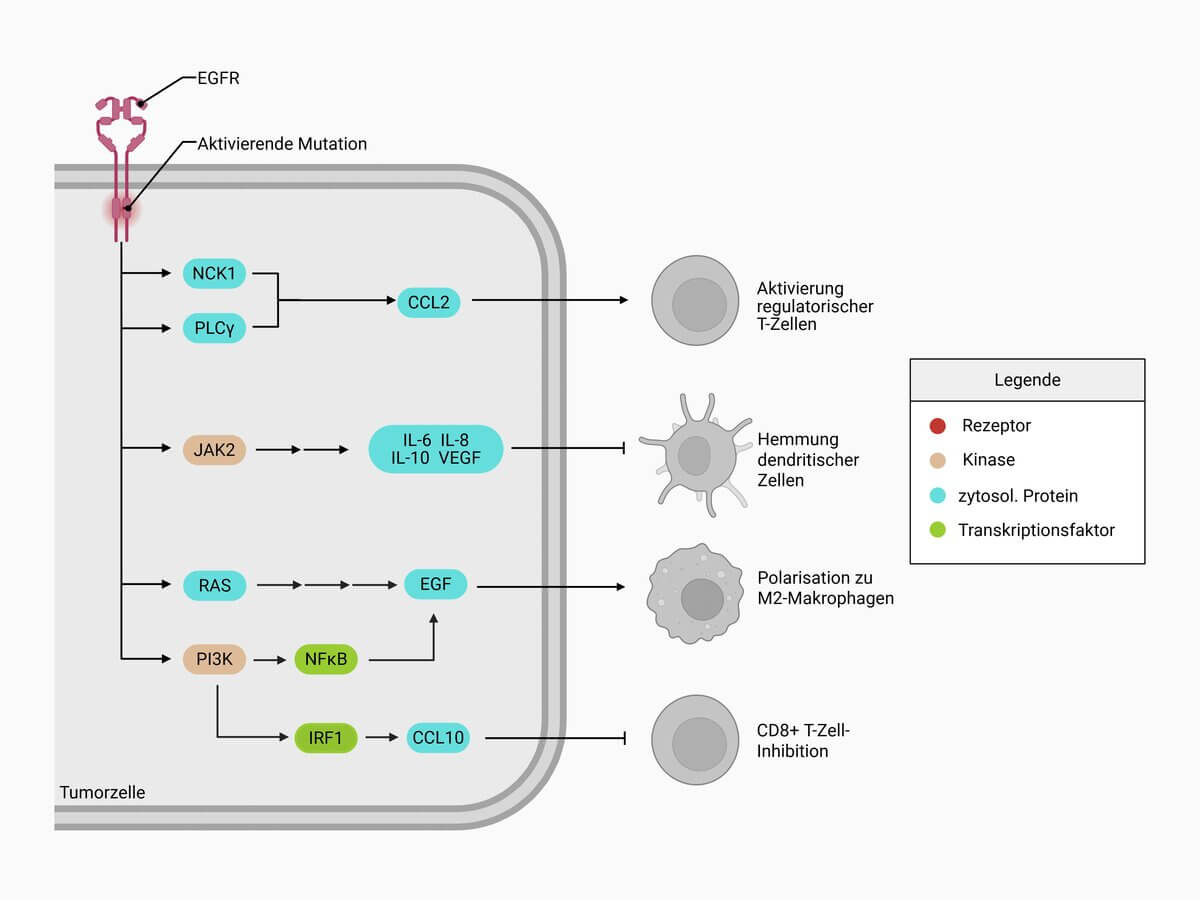
Signalkaskade
Die wichtigsten beiden Signalwege sind der Ras-Raf-MEK-ERK- sowie der PI3K-AKT-mTOR-Signalweg. Des Weiteren findet eine Aktivierung von STAT3/5 und Proteinkinase C statt. Das so weitergereichte Signal stimuliert letztendlich das Zellwachstum, verhindert den apoptotischen Zelltod und trägt somit zur Transformation der Zelle bei.
Onkogenese
Man findet eine deutliche Überexpression des Rezeptors in vielen nicht-kleinzelligen Bronchialkarzinomen, Glioblastomen, Nierenzellkarzinomen, Ovarialtumoren, Kolonkarzinomen und anderen Tumorentitäten. Mutationen sind in vielen der insgesamt 28 Exons, sowie in den Intronregionen beschrieben. Die Veränderungen umfassen Amplifikationen des EGFR-Gens, punktuelle Mutationen und Deletionen. Diese Mutationen führen zu einer Überaktivierung des Rezeptors, oft unabhängig von der Ligandenbindung, was zu einer kontinuierlichen Signalübertragung und damit zu einer gesteigerten Zellproliferation und Resistenz gegenüber Therapien führt.
Pharmakologie
Um das wachstumsfördernde Verhalten von EGF auf Tumoren zu unterbinden, wurden mehrere Strategien entwickelt.
Zu den erfolgreichsten Prinzipien gehört dabei die Zuhilfenahme von spezifischen Antikörpern (Cetuximab), sowie die Anwendung von kleinmolekularen Verbindungen (z.B. Gefitinib, Erlotinib), die spezifisch die Kinasefunktion des Rezeptors blockieren (Tyrosinkinaseinhibitoren).
Dabei haben die zirkadianen Unterschiede in der Aktitivität von EGFR einen Einfluss auf das Timing der EGFR-Hemmung. Der Grund dafür ist, dass EGFR blockiert wird, wenn Steroide an den Glukokortikoid-Rezeptor binden. Da der Glukokortikoid-Spiegel nachts sinkt, sind EGFR hauptsächlich nachts aktiv. In Tierexperimenten konnte gezeigt werden, dass eine EGFR-Hemmung in der Nacht das Tumorwachstum besser kontrolliert.