X-Inaktivierung
Synonyme: X-Chromosom-Inaktivierung, Lyonisierung
Englisch: X-inactivation, Lyonization
Definition
Als X-Inaktivierung bezeichnet man in der Humangenetik den epigenetischen Prozess, in dem ein X-Chromosom ganz oder weitgehend stillgelegt (inaktiviert) wird.
Geschichte
Die Geschlechtschromosomen X und Y haben sich aus ursprünglich identischen Autosomen entwickelt. Evolutionär trennten sie sich vor etwa 150 bis 300 Millionen Jahren, als ein bestimmtes Transkriptionsfaktor-Gen eine neue Variante mit geschlechtsdefinierenden Eigenschaften hervorbrachte. Das Vorhandensein dieses Allels (entspricht heute dem SRY-Gen auf dem Y-Chromosom) führte letztlich dazu, dass die Gonaden eine männliche Ausprägung bekamen, wohingegen das korrespondierende Allel auf dem X-Chromosom (entspricht heute SOX3) keine wesentliche Rolle in der Gonadenentwicklung spielte.
Aufgrund dessen, dass nur Zellen des einen Geschlechts das Chromosom mit dem SRY-Vorläufer besaßen, war klar, dass auf diesem Chromosom keine genetischen Besonderheiten, die letzlich für das Leben essenzielle Bedeutung haben könnte, vorliegen können. So begannen Abschnitte des Chromosoms zu degenerieren. Dies war auch der Grund, wieso nur wenige funktionstüchtige Gene übrig blieben, von denen die meisten nur beim Mann eine wesentliche Rolle spielen. Heute ist das Y-Chromosom wesentlich kleiner als das X-Chromosom und weist gleichzeitig auf seinem langen Arm weite Strecken hochrepetitiver, nichtkodierender DNA auf.
Im Zuge dieses Entwicklungsprozesses entstand das Problem, dass eine weibliche Zelle nun zwei X-Chromosomen (diploid) und somit auch zwei Exemplare der auf dem X-Chromosom liegenden Gene trägt. Im Gegenzug besitzt die männliche Zelle nur jeweils ein Exemplar. Damit diese "schädliche" Gendosis kompensiert werden kann, entwickelte die Zelle den komplexen Mechanismus der X-Inaktivierung. Dieser Prozess verhindert die Expression der meisten Gene auf einem der beiden X-Chromosome.
siehe auch: Lyon-Hypothese
Als evolutionäres Ergebnis erhält man heute ein großes X-Chromosom, das mit mehr als 800 proteinkodierenden Genen beladen ist (und fast gleich viele Pseudogene) sowie ein kleines X-Chromosom mit nur 45 bekannten proteinkodierenden Genen (mit über 320 Pseudogenen).
Epigenetik
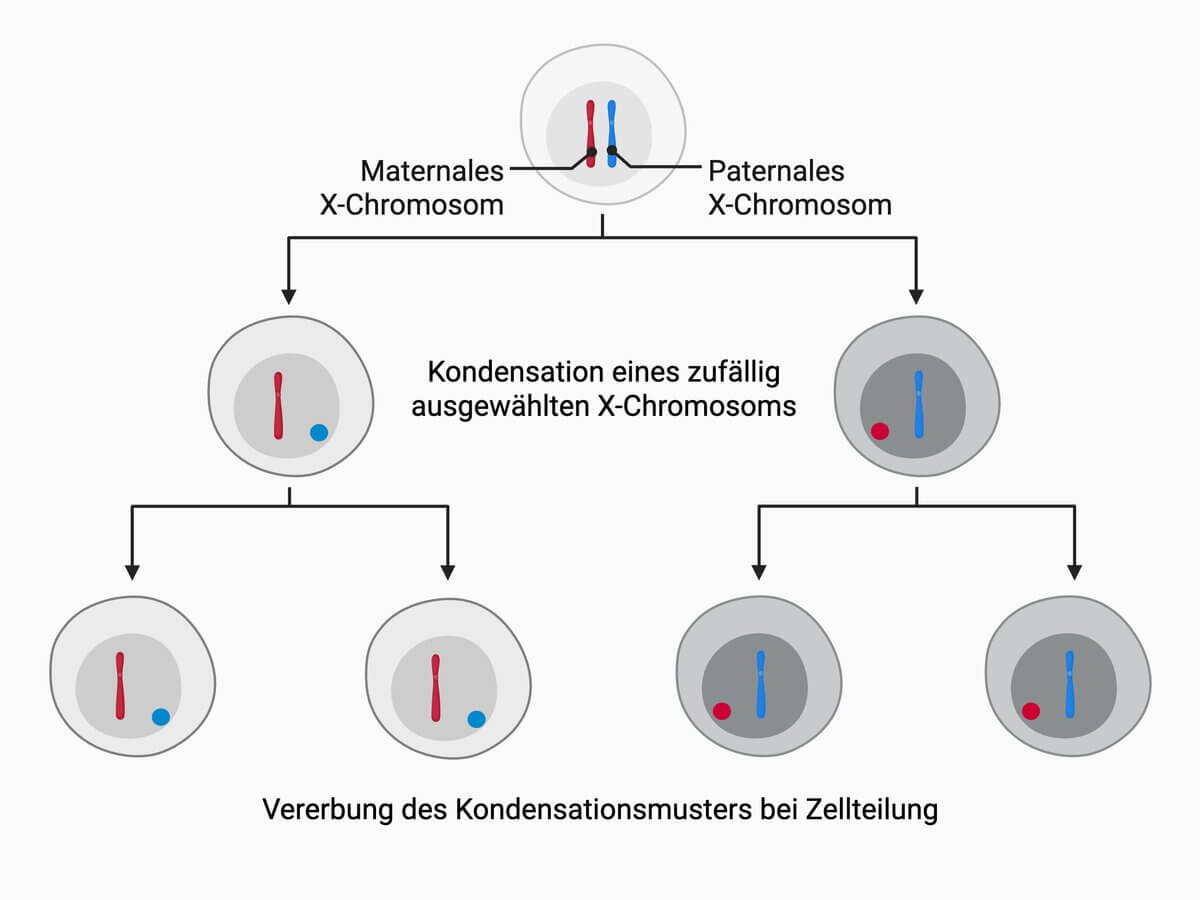
Die X-Inaktivierung findet in der frühen Embryogenese statt. Man geht davon aus, dass sie kurz nach der Befruchtung beginnt und nach etwa einer Woche (100-Zellstadium) abgeschlossen ist. In dieser Phase findet die X-Inaktivierung zufallsabhängig statt. Das heißt, dass mit gleicher Wahrscheinlichkeit entweder das mütterliche (Xm) oder das väterliche X-Chromosom (Xp) inaktiviert wird. Ab dem Zeitpunkt, an dem die Inaktivierung abgeschlossen ist, steht diese Entscheidung für alle aus ihr hervorgehenden Zellen fest. Alle nachfolgenden Zellen werden das gleiche inaktivierte X-Chromosom aufweisen.
Somit hat jede Frau mit Karyotyp 46,XX ein funktionelles Mosaik aus Zellen mit aktivem mütterlichem X-Chromosom und Zellen mit aktivem väterlichem X-Chromosom. Alle zusätzlichen X-Chromosome liegen als Heterochromatin vor, sind inaktiv und in Interphasezellen als Geschlechtschromatin oder Barr-Körperchen lichtmikroskopisch sichtbar.
Klinik
In den meisten Fällen bleibt nur ein X-Chromosom aktiviert. Deshalb besitzt ein Mann mit dem Karyotyp 46,XY kein Barr-Körperchen. Ein Mann mit 47,XXY hingegen hat ein Barr-Körperchen, genauso wie eine Frau mit 46,XX. Frauen mit dem Karyotyp 45,X (Turner-Syndrom) weisen kein Barr-Körperchen auf, eine Frau mit 47,XXX (Triple-X-Syndrom) hingegen gleich zwei. Eine Frau mit Karyotyp 48,XXXX besitzt dementsprechend drei Barr-Körperchen.
Als eine interessante Ausnahme dieser Regel gilt die Tetraploidie (z.B. 92,XXXX), bei der zwei X-Chromosome aktiv bleiben. Man schließt somit daraus, dass die X-Inaktivierung offensichtlich zumindest teilweise von der Zahl der Autosomen abhängt. Der genaue Ablauf bzw. Zusammenhang ist heute (2026) noch ungeklärt.
Molekulargenetik
Die molekulargenetischen Prozesse der Inaktivierung umfassen zwei Schritte:
- Methylierung von Cytosinen in CpG-Dinukleotiden in den Promotorbereichen der Gene,
- Modifikation (insbesondere Hypoacetylierung) der Histone.
Die zentrale Rolle in der Auslösung der X-Inaktivierung trägt das XIST-Gen (X inactive specific transcript), ein RNA-Gen im X-Inaktivierungszentrum (XIC) auf dem langen Arm des X-Chromosoms (Xq13), das wiederum auf dem zu inaktivierenden Xi-Chromosom aktiviert wird. Das ncRNA-Transkript von XIST umhüllt reversibel das inaktivierende X-Chromosom. Ein Verlust der RNA in diesem Stadium führt zur Reaktivierung der Gene. Anschließende DNA-Methylierung und andere Chromatinmodifikationen führen schlussendlich zu einer irreversiblen Ausbildung von Heterochromatin, das auch ohne XIST-RNA transkriptionell inaktiv bleibt.
Ungleiche X-Inaktivierung
Als ungleiche oder verschobene X-Inaktivierung bezeichnet man ein Phänomen, bei dem eine deutliche Verschiebung im Verhältnis der inaktivierten X-Chromosomen (mütterlichen und väterlichen Ursprungs) beobachtet werden kann. Dieses Phänomen ist von besonderem Interesse, wenn eines der beiden X-Chromosomen in seiner Struktur verändert ist oder gar ein Gen trägt, das bei der Trägerin oder bei der Vererbung an ein männliches Kind krankheitsverursachend wirken kann.[1]
Die X-Inaktivierung kann sich positiv oder negativ auf den Schweregrad der Symptome auswirken. So kann eine ungleiche X-Inaktivierung auch bei Frauen zu einer stärkeren Ausprägung von X-gebundenen rezessiven Erkrankungen führen, die sich sonst nur bei Männern manifestieren. Zum Beispiel weisen Konduktorinnen der Hämophilie A milde Blutungssymptome auf, wenn das nicht betroffene X-Chromosom häufiger inaktiviert wurde als das betroffene X-Chromosom, das keinen oder einen defekten Faktor VIII trägt.
Literatur
- "Basiswissen Humangenetik" - Christian P. Schaaf, Johannes Zschocke, Springer-Verlag, 2. Auflage