CT-Perfusion
von lateinisch: perfundere - durchströmen, durchfließen
Synonym: Perfusions-CT
Englisch: CT perfusion
Definition
Die CT-Perfusion bzw. das Perfusions-CT ist ein besonderes Verfahren der Computertomographie, das mit einem normalen CT-Gerät durchgeführt werden kann. Es wird aber zusätzlich mithilfe von Kontrastmitteln und spezieller Computersoftware die Durchblutung (Perfusion) des Gehirns, mitunter auch anderer Organe (u.a. Herz, Leber, Niere und Pankreas), gemessen und farblich dargestellt.
Hintergrund
Wenn es zu einer Ischämie kommt, greifen in Abhängigkeit von der Ischämiezeit verschiedene Mechanismen. Zu Beginn bleibt das Gewebe durch Autoregulation (z.B. Blutdrucksteigerung oder Vasodilatation) vital. Kommt es zu ersten, noch reversiblen hypoxischen Gewebeschäden, spricht man von "Penumbra" oder "tissue at risk". Dauert die Hypoxie weiter an, stirbt das Gewebe ab und infarziert. Diesen Teil des ischämischen Gewebes nennt man "Infarktkern".
Anwendung
Die CT-Perfusion kommt in erster Line zum Einsatz in der:
- Diagnostik des akuten Schlaganfalls: Nativaufnahmen (Graustufenbilder) sind für einen Nicht-Radiologen oft schwer interpretierbar. Mittels CT-Perfusion lassen sich anschauliche Farbbilder erzeugen, die zusätzlich qualitative und quantitative Informationen über die Durchblutung des Gehirns liefern, sodass die diagnostische Aussagekraft erhöht wird.
- Tumorbeurteilung: Zusätzlich zu der üblichen CT-Diagnostik, die Informationen über die räumliche Ausdehnung, Anatomie und Kontrastmittelaufnahme des Tumors enthält, ermöglicht die CT-Perfusion eine genauere Einschätzung der Durchblutung eines Tumors, die auch farblich dargestellt werden kann. Sie kann außerdem der Differenzierung zwischen einer Strahlennekrose und einem Tumorrezidiv dienen.
- Myokardiale CT-Perfusion: Beurteilung der myokardialen Durchblutung.
siehe auch: CT-Perfusion (Hirninfarkt)
Prinzip
Die CT-Perfusion wird üblicherweise nicht isoliert, sondern in Kombination mit einem nativen Schädel-CT (CCT) und einer CT-Angiographie (CTA) durchgeführt.
Scan
Für die CT-Perfusion erfolgt eine intravenöse Kontrastmittelinjektion mit möglichst hoher Flussrate. Daraufhin wird wiederholt der Bereich von Interesse des Gehirns zu mehreren Zeitpunkten gescannt (z.B. im 1,5-Sekundentakt über eine Dauer von 40 Sekunden).[1] Hierdurch wird ein 4D-Datensatz (= zeitlich aufgelöster 3D-Datensatz) generiert, der die Anflutung und Abflutung des Kontrastmittels in den Hirngefäßen und im Hirnparenchym zeigt.
Nachverarbeitung
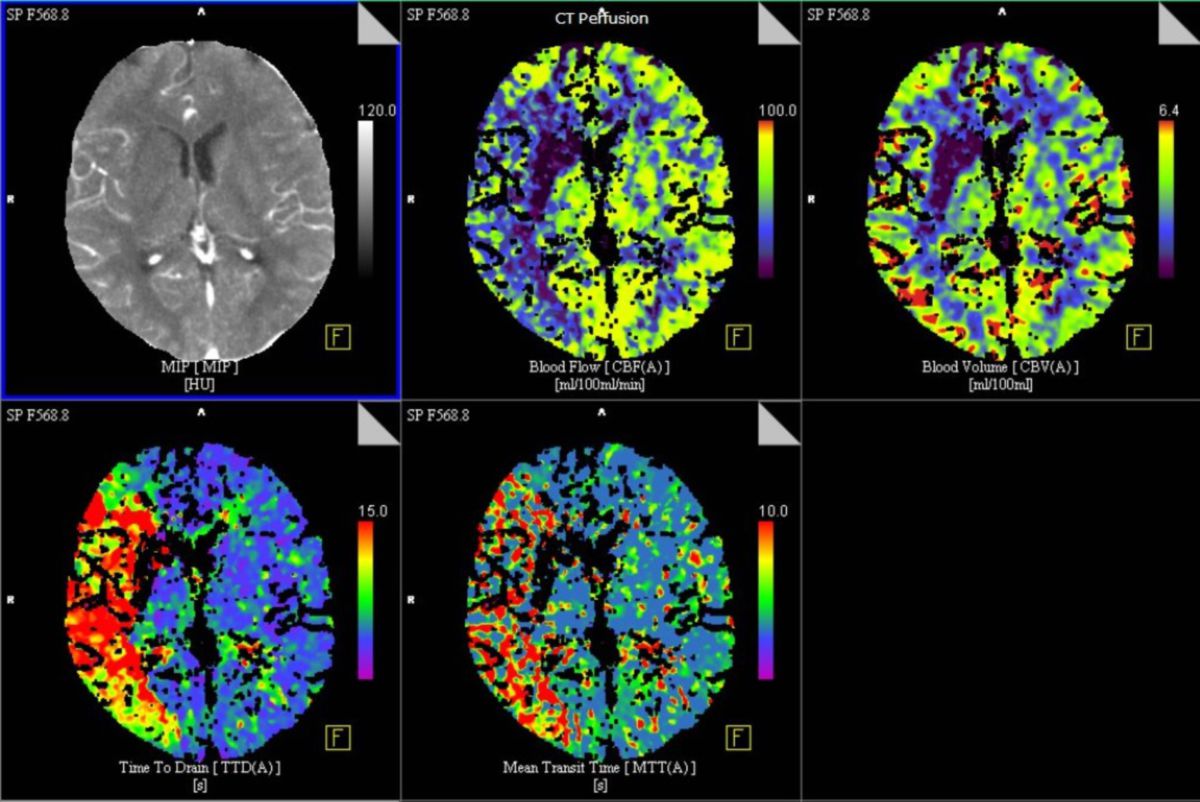
Aus dem erzeugten 4D-Datensatz lassen sich mit spezieller Postprocessing-Software folgende Parameter errechnen:
- Zerebraler Blutfluss (CBF): Er gibt an, wie viel Volumen Blut (ml) pro Masse Gewebe (g) pro Zeit (min) fließt. Einheit: ml/g/min
- Zerebrales Blutvolumen (CBV): Dieser Wert gibt an, wie viel Volumen Blut (ml) pro Masse Gewebe (g) vorzufinden ist.
- Time-to-peak (TTP): Sie gibt an, wie viel Zeit ein Kontrastmittel-Bolus benötigt, bis er sich in einer bestimmten Gewebe-Region maximal anreichert (Zeit bis zur maximalen Hyperdensität).
- Mean transit time (MTT): Sie gibt an, wie lange ein Kontrastmittel-Bolus braucht, um aus einer zuführenden Arterie durch das interessierende Gewebe in ein venöses Gefäß überzutreten.
- Gewebe-Permeabilität (P): Dieser Wert gibt an, wie viel Volumen Blut (ml) pro Masse Gewebe (g) pro Zeit (min) in das interessierende Gewebe gelangt. Einheit: ml/g/min
Diese Parameter werden farblich als Color maps (Parameterbilder) dargestellt und vom Radiologen ausgewertet.
Die Berechnung dieser Parameter erfolgt mithilfe von Algorithmen, die in der Regel auf dem Maximum-Slope-Modell oder Methoden der Dekonvolutionsanalyse beruhen.[2]
Interpretation
Durch eine Kombination der o.g. Parameter kann zwischen Infarktkern ("non-viable tissue") und evtl. noch durch Thrombolyse und/oder Thrombektomie zu rettender Penumbra ("tissue at risk") unterschieden werden.
Zerebrales Blutvolumen
Das zerebrale Blutvolumen kann zu Beginn einer Ischämie durch Autoregulation zunehmen und über dem Normwert liegen. In der Penumbra sinkt das CBV wieder auf den Normwert ab. Sobald das CBV unter den Normwert fällt, spricht man vom Infarktkern.
Zerebraler Blutfluss
Der zerebrale Blutfluss kann in der Autoregulationsphase noch normwertig sein. In der Penumbra und im Infarktkern nimmt der CBF kontinuierlich ab.
Time-to-peak und Mean transit time
Die Time-to-peak und die Mean transit time steigen ab der Phase der Autoregulation kontinuierlich an und sind im Infarktkern am höchsten. Beide Parameter sind eher unspezifisch und können z.B. durch eine vorgeschaltete Stenose erhöht sein.
Mismatch
Von einem Mismatch spricht man, wenn der zerebrale Blutfluss (CBF) bereits vermindert ist, das zerebrale Blutvolumen (CBV) jedoch noch normwertig, oder durch Autoregulation sogar leicht erhöht ist. Bei dem Gewebe, in dem diese Konstellation beobachtet wird, handelt es sich um Penumbra, die potenziell gerettet werden kann.
Die Frage, ob noch ein Mismatch zwischen überlebensfähigem und nicht mehr überlebensfähigem Gewebe besteht, ist in vielen Zentren heute mittlerweile ein wichtiges Entscheidungskriterium für die weitere Therapieplanung. Während in der Vergangenheit ein Zeitfenster von 4,5 h galt, nach welchem eine Lyse-Therapie nicht mehr durchgeführt wurde, konnte in den letzten Jahren gezeigt werden, dass auch zu späteren Zeitpunkten noch eine erfolgreiche Lyse und insbesondere Thrombektomie möglich ist, unter der Voraussetzung, dass in der CT-Perfusion noch ein Mismatch besteht.
Vor- und Nachteile
Die CT-Perfusion bietet in Ergänzung zu CCT und CTA folgende Vor- und Nachteile:
Vorteile
- Höhere Sensitivität bei der Erkennung eines Schlaganfalls
- Differenzierbarkeit von unwiederbringlich geschädigtem Hirngewebe (Kerninfarkt) und möglicherweise noch zu rettendem Hirngewebe (Penumbra)[3]
- Beurteilung von Gefäßkollateralen
- Evaluation der Therapieindikation bei erweitertem oder unklarem Zeitfenster
Nachteile
- Höherer Zeitaufwand: die Untersuchungszeit im Raum erhöht sich um ca. 5 min. Der eigentliche Perfusions-Scan dauert je nach Protokoll bis zu 1 min.
- Höhere Strahlenbelastung: DLP je nach Protokoll ca. 2.200 mGy*cm (zum Vergleich CCT ca. 700–800 mGy*cm, CTA ca. 300–400 mGy*cm)
- Höhere Kontrastmittelmenge bzw. zusätzliche Kontrastmittelgabe
- Höherer Material- und Personalaufwand und somit höhere Kosten: aufwändige Nachverarbeitung der CT-Daten durch eine qualifizierte MTRA oder Radiologen sowie dedizierte Auswertung durch Radiologen.
Quellen
- ↑ B. Abels, E. Klotz, B.F. Tomandl, J.P. Villablanca, S.P. Kloska and M.M. Lell: CT Perfusion in Acute Ischemic Stroke: A Comparison of 2-Second and 1-Second Temporal Resolution; American Journal of Neuroradiology October 2011, 32 (9) 1632-1639
- ↑ B. Abels, E. Klotz, B.F. Tomandl, S.P. Kloska and M.M. Lell: Perfusion CT in Acute Ischemic Stroke: A Qualitative and Quantitative Comparison of Deconvolution and Maximum Slope Approach; American Journal of Neuroradiology October 2010, 31 (9) 1690-1698]
- ↑ Abels, B., Villablanca, J.P., Tomandl, B.F. et al.: Acute stroke: a comparison of different CT perfusion algorithms and validation of ischaemic lesions by follow-up imaging; Eur Radiol (2012) 22: 2559. doi:10.1007/s00330-012-2529-8