Thalidomid
Handelsnamen: Thalidomide CelgeneTM, früher: Contergan®
Englisch: thalidomide
Definition
Thalidomid ist ein Glutaminsäurederivat mit zentral dämpfenden, immunsuppressiven und entzündungshemmenden Wirkungen. Er ist seit 2008 unter strengen Richtlinien zur Behandlung des multiplen Myeloms und anderer Erkrankungen zugelassen.
Geschichte
Thalidomid wurde 1954 von der Firma Grünenthal in Aachen entwickelt und ab 1957 als Schlaf- und Beruhigungsmittel unter dem Markennamen Contergan® in Deutschland rezeptfrei verkauft. Der Arzneistoff wurde auch von vielen Schwangeren eingenommen, da die teratogenen Wirkungen zu diesem Zeitpunkt noch nicht bekannt waren. Durch die Einnahme von Contergan in der Frühschwangerschaft kam es zu einer Häufung von schweren Fehlbildungen (Dysmelien, Amelie) bei den Kindern dieser Frauen. Das Medikament wurde daraufhin 1961 in Deutschland vom Markt genommen.
siehe auch: Contergan-Skandal
Chemie
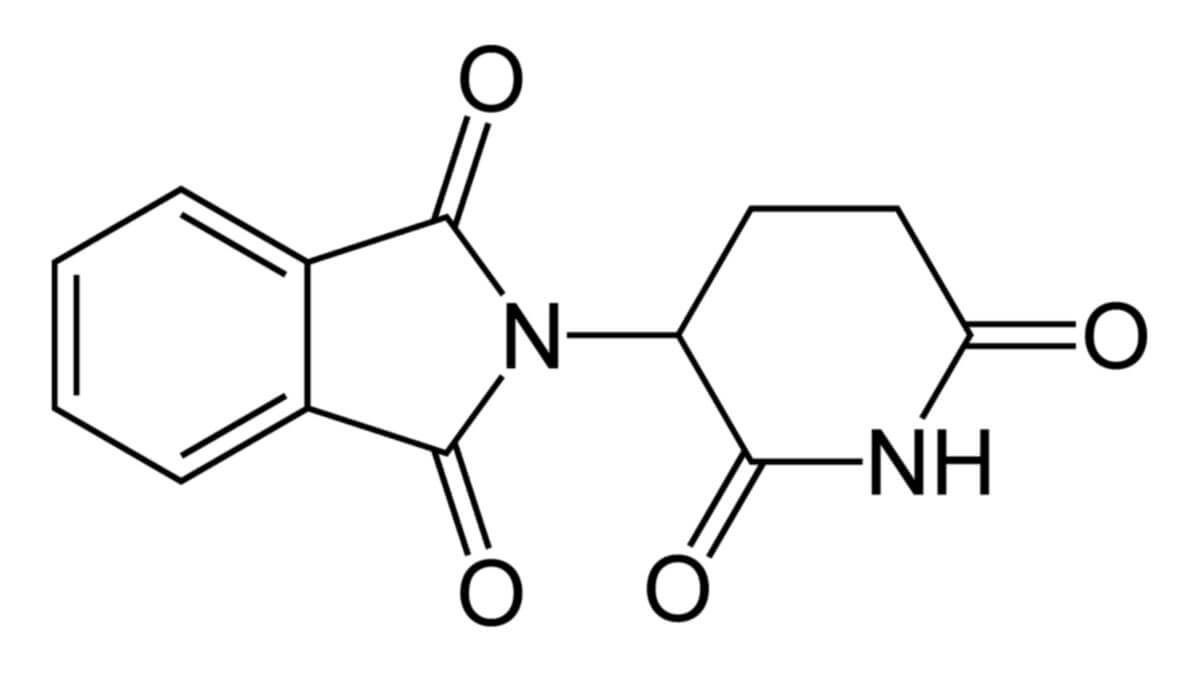
Die molare Masse von Thalidomid beträgt 258,23 g/mol.[1] Es gehört zur Gruppe der Piperidindione, die eine strukturelle Abwandlung der Barbiturate sind. Thalodomid ist eine chirale Verbindung, das heißt das Molekül kann in zwei spiegelverkehrten Formen vorliegen. Man spricht dabei von S- oder R-Form. Pharmazeutisch verwendet wird das Racemat, also die Mischung beider Formen.
Wirkprofil
Thalidomid wirkt beruhigend und schlaffördernd. Außerdem hat es entzündungshemmende, antineoplastische sowie antiangiogenetische Eigenschaften. Ende der 1950er Jahre wurde Contergan auch wegen der Wirkung von Thalidomid gegen Übelkeit beworben.
Wirkmechanismus
Der Wirkmechanismus von Thalidomid ist nicht vollständig geklärt. Angenommen wird eine Hemmung der TNFα-Produktion[2] und eine Bindung an das Protein Cereblon, wodurch u.a. die Leukozytenmigration, Angiogenese und der Zellstoffwechsel beeinflusst werden.[1]
Pharmakokinetik
Thalidomid wird nach oraler Einnahme langsam resorbiert, die Tmax liegt bei 1 bis 5 Stunden. Die Einnahme zu einer Mahlzeit verlangsamt die Resorption, wobei die AUC jedoch gleich bleibt. Der Dostsche Flächensatz ist für die Resorption von Thalidomid erfüllt. Thalidomid wird größtenteils über Hydrolyse ohne enzymatische Einflüsse metabolisiert. Die Metaboliten werden vor allem über den Urin ausgeschieden. Die Eliminationshalbwertszeit beträgt 5,5 bis 7,3 Stunden. Eine Dosisanpassung für Leber- bzw. Nierenfunktionsstörung ist nach aktuellem Stand nicht erforderlich, da Thalidomid nicht über CYP-Enzyme in der Leber metabolisiert bzw. nicht unverändert über die Niere eliminiert wird.[2]
Indikation
Aufgrund seiner entzündungshemmenden und tumorwachstumshemmenden Wirkung wird Thalidomid in bestimmten Indikationen wieder zur medikamentösen Therapie eingesetzt, u.a. bei Lepra, multiplem Myelom sowie bei verschiedenen Haut- und Autoimmunkrankheiten.
Empfängnisverhütung
Voraussetzungen für den Einsatz bei Frauen sind eine konsequente Empfängnisverhütung und regelmäßige Schwangerschaftstests (alle 4 Wochen) während der Therapie, unabhängig von der sexuellen Aktivität. Die Empfängnisverhütung muss 4 Wochen vor Therapie begonnen, und nach Ende der Therapie 4 Wochen lang fortgeführt werden. Auch bei einer eventuellen Unfruchtbarkeit oder Amenorrhoe der Frau sollte nicht von diesen Vorgaben abgewichen werden. Laut der Fachinformation kann nur bei einer nachweisbaren Tubenligatur auf Schwangerschaftstests verzichtet werden.
Männliche Patienten, die sexuellen Kontakt mit einer gebärfähigen Frau haben, müssen ein Kondom benutzen, da Thalidomid in das Ejakulat übergeht. Diese Vorschrift gilt auch bei einer nachweisbaren Vasektomie.
Nebenwirkungen
Allgemeine Nebenwirkungen
Die häufigsten Nebenwirkungen von Thalidomid sind Somnolenz und Obstipation. Es können zudem ernste Nebenwirkungen wie tiefe Beinvenenthrombosen und periphere Neuropathien auftreten.[3]
Fetotoxizität
Wird Thalidomid in den ersten drei Monaten der Schwangerschaft eingenommen, hat es weitreichende Auswirkungen auf die Entwicklung des Embryos. Es blockiert den Wachstumsfaktor VEGF (Vascular Endothelial Growth Factor), wodurch die Bildung der Blutgefäße gehemmt wird. Zudem bindet Thalidomid das Protein Cereblon, das mit weiteren Proteinen einen Ubiquitinligase-Komplex bildet. Dieser Komplex steuert unter anderem die Morphogenese der Gliedmaßen. Dementsprechend kommen die Neugeborenen mit erheblichen Fehlbildungen der Gliedmaßen und/oder der inneren Organe auf die Welt.[4]
Es ist in der Wissenschaft strittig, ob man einer der beiden Formen des Thalidomids die teratogene Wirkung zuschreiben kann, da im Contergan sowohl die S- als auch die R-Form vorlagen. Einige Wissenschaftler halten nur die S-Form für schädlich, während andere der Auffassung sind, dass es keine ungefährliche Form gibt, da sich beide Formen im Körper ineinander umwandeln.
Verordnung
In Deutschland wird die Abgabe Thalidomid durch den § 3a der Arzneimittelverschreibungsverordnung reguliert. Für die Verordnung muss ein T-Rezept verwenden werden. Darüber hinaus sind die behandelnden Ärzte verpflichtet, ihre Patientinnen und Patienten umfangreich aufzuklären. U.a. müssen die Patienten schriftlich versichern, dass sie unter Thalidomid-Therapie keine Schwangerschaft anstreben bzw. entsprechende Verhütungsmaßnahmen ergreifen werden.
Rezepturen
Derzeit stehen zwei thalidomidhaltige NRF-Rezepturen zur Verfügung.
- Thalidomid-Saft 2 % (m/V) (NRF 32.1.) ad 100,0 ml
- Thalidomid-Kapseln 50 mg / 100 mg / 150 mg / 200 mg (NRF 32.2.) ad 50 Stück
Weblinks
Quellen
- ↑ 1,0 1,1 Gelbe Liste; Thalidomid; abgerufen am 22.09.2024
- ↑ 2,0 2,1 Rote Liste; THALIDOMID BMS® 50 mg Hartkapseln; Fachinformation
- ↑ Dimopoulos et al.: Adverse effects of thalidomide administration in patients with neoplastic diseases, Am J Med, 2004
- ↑ Ito, T., H. Ando, T. Suzuki, T. Ogura, K. Hottaet al., 2010 Identification of a primary target of thalidomide teratogenicity. Science 327 (5971):1345–1350.