Kollagen
von altgriechisch: κόλλα ("kólla") - Leim; -γενής ("-genēs") - hervorbringend, hervorgebracht
Synonym: Collagen
Englisch: collagen
Definition
Die Familie der Kollagene stellt eine heterogene Gruppe von Proteinen dar, die etwa ein Viertel der Gesamtproteinmenge im menschlichen Organismus ausmachen. Kollagen ist der wichtigste Faserbestandteil von Haut, Knochen, Sehnen, Knorpel, Blutgefäßen und Zähnen. Bisher konnten 25 Kollagenpolypeptide beschrieben werden, die über 28 unterschiedliche Kollagentypen in der extrazellulären Matrix aufbauen.
Struktur
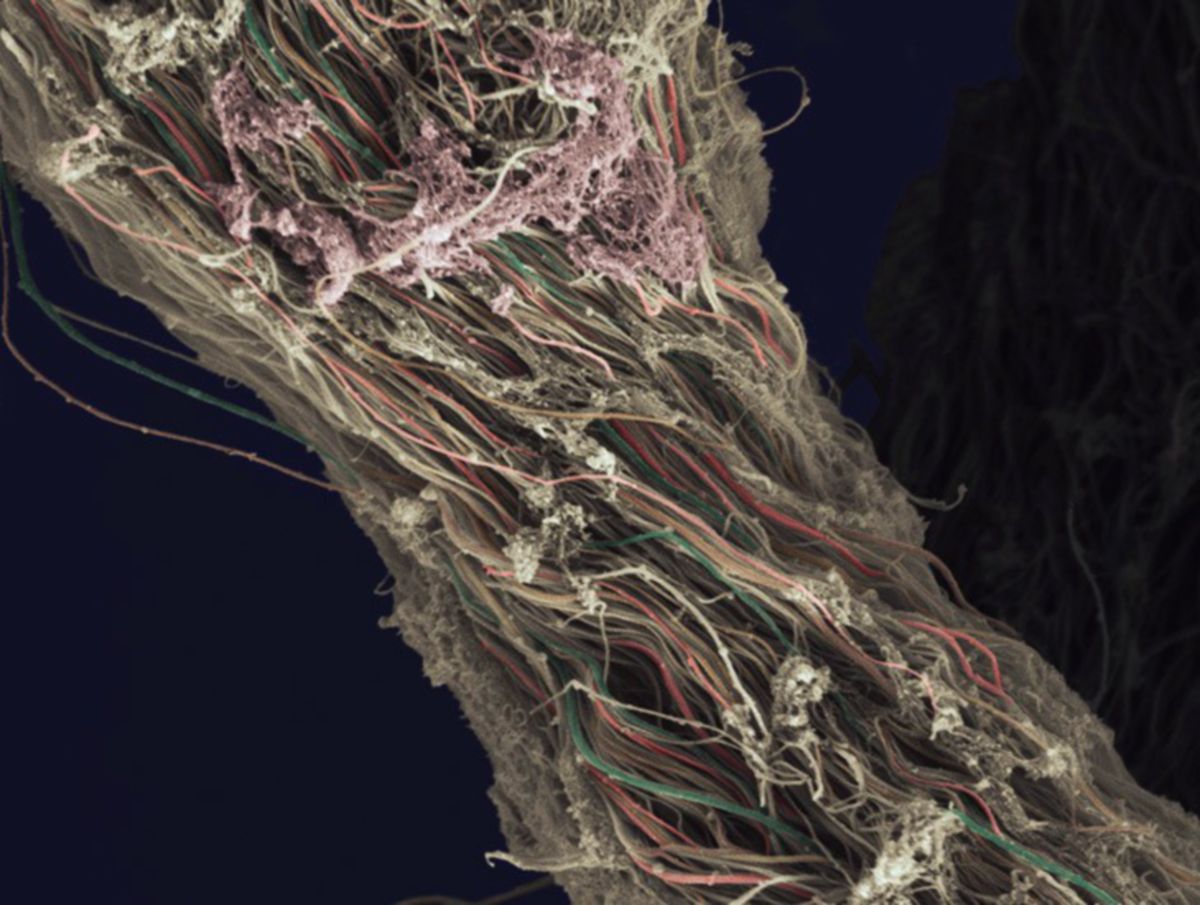
Kollagenmolekül
Die Tertiärstruktur der Kollagenmoleküle besteht aus linksgängigen helikalen Aminosäureketten (Prokollagen), von denen sich jeweils drei in Form einer rechtsgängigen Superhelix bzw. Tripelhelix umeinander winden und auf diese Weise Fasern ausbilden, die als Tropokollagen bezeichnet werden. Die Tripelhelix wird durch Wasserstoffbrückenbindungen zwischen den einzelnen Strängen stabilisiert.
Die Kollagenketten weisen einen hohen Anteil an Prolin und Glycin auf, daneben eine Reihe hydroxylierter Aminosäuren wie Hydroxyprolin und Hydroxylysin, die eine Quervernetzung der Proteine und die Ausbildung einer stabilen Kollagenmatrix ermöglichen.
Die entstandenen Fasern sind zwar helikal, unterscheiden sich strukturell aber von der klassischen α-Helix. Durch den hohen Gehalt an Prolinen und Glycinen sind die Helices des Kollagens länger gestreckt, was in einer Ganghöhe (die Strecke, die eine volle Umdrehung der Schraube nach oben einnimmt) von 0,94 nm resultiert. Eine α-Helix hat dagegen eine Ganghöhe von 0,54 nm. Die langgestreckte Form der Proteinketten führt dazu, dass die Tripelhelix des Kollagens sehr kompakt und eng ist. Jede Kollagenhelix kann - in Abhängigkeit von ihrem genauen Typ - aus mehreren Hundert bis mehreren Tausend Aminosäuren aufgebaut sein.
Kollagenfibrillen
Durch Aggregation mehrerer Kollagenmoleküle entsteht die nächst höhere Organisationseinheit, die Kollagenfibrillen. Die Kollagenmoleküle werden bei der Bildung der Fibrillen nicht einfach gebündelt, sondern um ca. 1/5 ihrer Länge (67 nm) gegeneinander versetzt. Dadurch entsteht im elektronenmikroskopischen Bild eine charakteristische Querstreifung, die sich alle 67 nm (234 Aminosäuren) wiederholt. Sie wird als D-Periode bezeichnet.
Die Bildung der Kollagenfibrillen aus den Tropokollagen-Untereinheiten erfolgt spontan im Extrazellulärraum. Die Ausrichtung wird dabei von Fibroblasten gesteuert, die fertig geformte Fibrillen mithilfe sogenannter Fibripositoren ausrichten.
Kollagenfibrillen haben in verschiedenen Geweben einen sehr unterschiedlichen Durchmesser, der von 20 nm bis etwa 500 nm reicht. Durch diese Variationsbreite kann die Struktur der Fibrillen variabel an die Erfordernisse des jeweiligen Gewebes angepasst werden. In der Kornea haben die Fibrillen beispielsweise einen sehr geringen Durchmesser (25 nm), um eine Transparenz der Hornhaut zu ermöglichen.
Physiologie
Kollagen findet sich im Organismus vor allem in Bindegewebe, wo es je nach Beschaffenheit den Großteil der extrazellulären Matrix ausmachen kann. Die unterschiedliche Beschaffenheit der verschiedenen Kollagentypen liegt einer Vielzahl von Eigenschaften des Binde- und Stützgewebes zugrunde. Die Reißfestigkeit von Bändern und Sehnen, die Flexibilität von Knochen oder die Druckresistenz der Gelenkknorpel ist großenteils durch das im Gewebe vorherrschende Kollagen bedingt.
Kollagen ist das Protein mit dem höchsten relativen Anteil (etwa 25 %) am Gesamtprotein des Menschen.
Pathophysiologie
Die Synthese von Kollagen ist Ascorbinsäure-abhängig. Ein Mangel an Vitamin C ruft das Krankheitsbild des Skorbuts hervor. Eine Vielzahl genetischer Erkrankungen beruhen auf Defekten des Kollagens oder damit assoziierter Proteine (beispielsweise Ehlers-Danlos-Syndrom, Osteogenesis imperfecta, Stickler-Syndrom, Alport-Syndrom).
Systematik
Bisher sind eine Reihe von Kollagentypen entdeckt worden, deren Funktion jedoch teilweise noch ungeklärt ist.
- Kollagen I (faserbildend in Kollagenfasern): Haut, Sehnen, Knochen, Dentin, Faserknorpel, Kornea
- Kollagen II (faserbildend): Hyaliner Knorpel, Faserknorpel, Elastischer Knorpel, Glaskörper
- Kollagen III (faserbildend in Retikulinfasern): Haut, Skelettmuskulatur, Blutgefäße
- Kollagen IV (netzförmig): Basallamina (bes. Lamina densa)
- Kollagen V (faserbildend): Fetale Gewebe, Plazenta, interstitielles Bindegewebe, Kornea
- Kollagen VI (faserassoziiert, kugelförmig): Bindegewebe
- Kollagen VII (Ankerfibrillen): Verankerung von Epithelien auf Basalmembran und Stroma
- Kollagen VIII (netzförmig): Descemet-Membran
- Kollagen IX (faserassoziiert): Knorpel, Corpus vitreum
- Kollagen X (netzförmig): Wachstumszone des Knorpels
- Kollagen XI (faserbildend): Knorpel
- Kollagen XII (faserassoziiert): embryonale Haut, embryonale Sehnen
- Kollagen XIII: Knochen, Knorpel, Haut, quergestreifte Muskulatur
- Kollagen XIV: vor allem im intraneuralen Bindegewebe der Nerven, im Epi- und Perimysium, auch innerhalb des Muskels nach einer Denervation
- Kollagen XV: Basalmembran der Muskeln, in den Nieren nach einer Fibrosierung
- Kollagen XVI: in inneren Organen, in den Augen und etwas im Muskelgewebe
- Kollagen XVII (transmembranär): Assoziation mit Hemidesmosomen von Plattenepithelzellen der Epidermis
- Kollagen XVIII: unbekannt
- Kollagen XIX: (faserassoziiert): fetale Haut, fetale Sehnen
Wirtschaftliche Relevanz
Aus durch Säure oder Hitze denaturiertem, tierischen Kollagen wurde in der Vergangenheit "Knochenleim" hergestellt. Heute werden aus Kollagenfasern resorbierbare Nahtmaterialien und Hauttransplantate synthetisiert. In der kosmetischen Chirurgie wurde Kollagen als Injektionsmaterial zur Formung äußerer Strukturen des Körpers (beispielsweise Lippen) und zur Faltenunterspritzung verwendet.