Ubiquitinierung
Synonym: Ubiquitinylierung
Englisch: ubiquitination, ubiquitylation
Definition
Biochemie
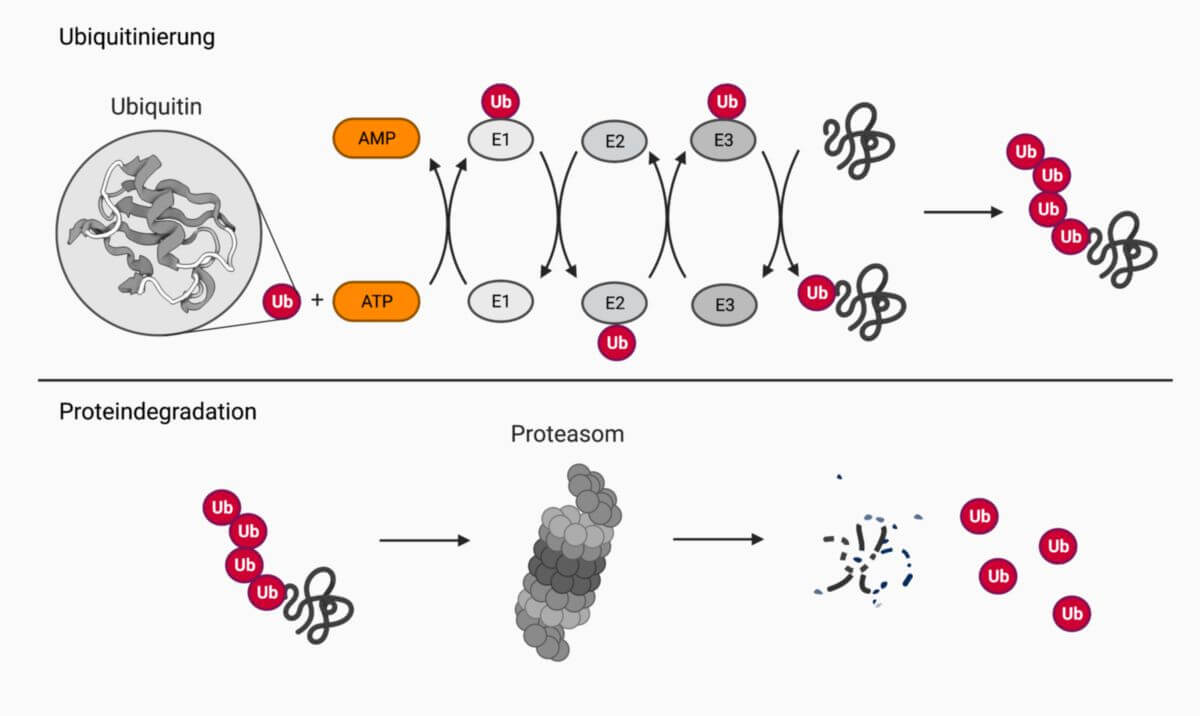
Ubiquitin wird über eine Drei-Enzym-Kaskade aktiviert und auf das Substrat übertragen. Im ersten Schritt adenyliert das aktivierende E1-Enzym Ubiquitin am C-Terminus mit Hilfe von ATP und aktiviert es so. Dies führt zur kovalenten Bindung von Ubiquitin an das E1-Enzym durch eine energiereiche Thioesterbindung zwischen dem Cystein im aktiven Zentrum der E1-Ligase und dem Glycin G76 am C-Terminus des Ubiquitins. Dabei wird AMP freigesetzt.
Im nächsten Schritt wird das aktivierte Ubiquitin auf das E2-konjugierende Enzym (E2-Enzym) übertragen. Als letztes wird Ubiquitin auf das Zielprotein konjugiert, indem mittels einer E3-Proteinligase (E3-Enzym) eine Isopeptidbindung zwischen der ε-Aminogruppe eines internen Lysins des Substrats mit dem C-Terminus des Ubiquitins gebildet wird.
Grundsätzlich kann zwischen der Mono- und Polyubiquitinierung von Proteinen unterschieden werden. Bei der Monoubiquitinierung wird nur ein einzelnes Ubiquitin-Molekül an ein Substrat gebunden. Bei der Polyubiquitinierung werden Ubiquitinketten gebildet. Die Ubiquitin-Reste werden dabei ebenfalls über Isopeptidbindungen verknüpft, wobei das C-terminale Glycin eines Ubiquitins mit einem internen Lysin-Rest eines anderen Moleküls die Bindung eingeht. Insgesamt sind sieben spezifische Lysine in der Aminosäuresequenz des Ubiquitins bekannt, über die Polyubiquitinketten ausgebildet werden: K6, K11, K27, K29, K33, K48 und K63. Je nachdem, an welchem Lysin die Ubiquitinierung stattfindet, wird das Zielmolekül weiterprozessiert. K48- und K11-gekoppelte Polyubiquitinketten führen zum Abbau im Proteasom.
Funktion
Die Ubiquitinierung dient dazu, die Eigenschaften und Aktivitäten ihrer Zielproteine zu modifizieren. So können die Ubiquitin-Reste zum Beispiel die Interaktion des Zielproteins mit anderen Proteinen fördern oder hemmen oder seine Lokalisation in der Zelle verändern. Eine der wichtigsten Funktionen ist jedoch der Abbau der polyubiquitinierten Proteine im Proteasom. Dieses zusammengehörige System bezeichnet man daher auch als Ubiquitin-Proteasom-System.
Durch ihren Einfluss auf die Proteinaktivität sind Ubiquitinierungen direkt oder indirekt in zahlreiche Zellprozesse eingebunden, u.a. in die Steuerung von Transkription und Translation, in die Signaltransduktion und in die DNA-Reparatur.
siehe auch: Ubiquitin