Ubiquitin-Proteasom-System
Englisch: ubiquitin proteasome system
Definition
Das Ubiquitin-Proteasom-System, kurz UPS, bildet neben der Autophagie das zweite intrazelluläre Abbausystem für Proteine (Proteindegradation). Es basiert auf der Markierung der Proteinsubstrate durch Ubiquitin-Modifikationen, die zur Erkennung und dem Abbau durch das Proteasom führen.
Funktion
Der Abbau von Proteinen dient meist dazu, fehlgefaltete und dysfunktionale Eiweiße aus der Zelle zu entfernen. Zum Teil werden auch zelluläre Signalwege durch den Abbau ihrer Komponenten terminiert. Auf der anderen Seite ist der Abbau von Proteinen ein wichtiger Bestandteil des anabolen Stoffwechsels, der Aminosäuren für die Neusynthese von Proteinen zur Verfügung stellt.
Basismechanismus
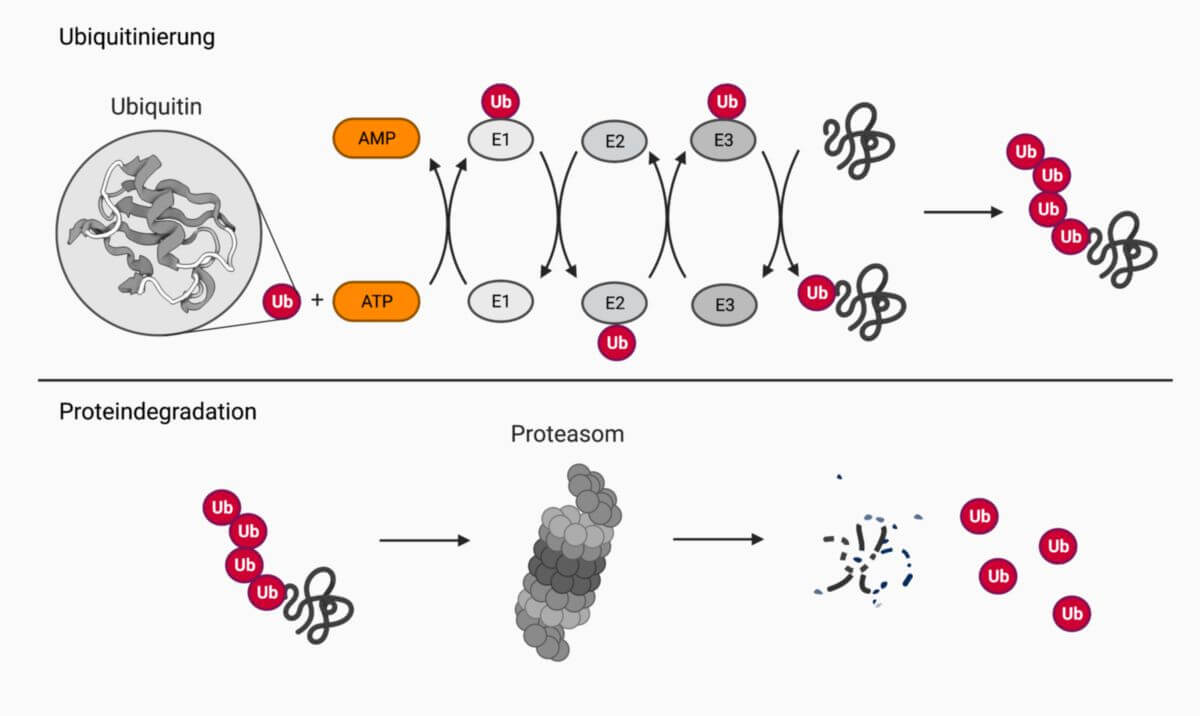
Die Ubiquitinierung von Proteinen ist ein Prozess, an dem drei Enzyme beiteiligt sind: das Ubiquitin-aktivierende Enzym (E1), ein Ubiquitin-konjugierendes Enzym (E2) und eine Ubiquitinligase (E3). Im menschlichen Genom sind nur zwei verschiedene E1-Enzyme, etwa fünfzig E2-Enzyme und mehrere hundert E3-Enzyme kodiert. Somit kann eine Vielzahl von Proteinsubstraten erkannt und reguliert werden. Die Erkennung der Substrate beruht auf sogenannten Degrons, kurzen Aminosäuresequenzen, die durch Untereinheiten der Ubiquitinligase erkannt und gebunden werden.
Im darauffolgenden Schritt werden die ubiquitinierten Proteine in der Zelle zum Proteasom rekrutiert. Dieser zylinderförmige Multiproteinkomplex übernimmt die Proteasefunktion und spaltet die Peptidbindung zwischen den Aminosäuren. Somit werden die Proteine in kleine Peptid-Einheiten zerlegt, die weiter zu einzelnen Aminosäuren aufgespalten werden.