δ-Aminolävulinsäuredehydratase
Synonyme: δ-Aminolävulinsäure-Dehydratase, δ-Aminolävulinatdehydratase, Delta-Aminolävulinsäure-Dehydratase, Porphobilinogen-Synthase, Porphobilinogensynthase
Englisch: porphobilinogen synthase
Definition
Biochemie
Das Protein δ-Aminolävulinsäuredehydratase tritt in zwei Isoformen auf. Isoform 1 (ALAD-1) besteht aus 330 Aminosäuren und hat ein Molekulargewicht von 36,3 Kilodalton. Isoform 2 (ALAD-2) ist aus 359 Aminosäuren zusammengesetzt und wiegt 39,0 Kilodalton. Das aktive Enzym ist ein Oktamer aus acht identischen Untereinheiten, die ein Zinkion als Kofaktor gebunden haben. Es wird durch verschiedene Faktoren allosterisch reguliert, wobei das aktive Oktamer zu einem inaktiven Hexamer umgelagert wird.
Genetik
Die δ-Aminolävulinsäuredehydratase wird durch das Gen ALAD auf Chromosom 9 am Genlokus 9q32 kodiert.
Funktion
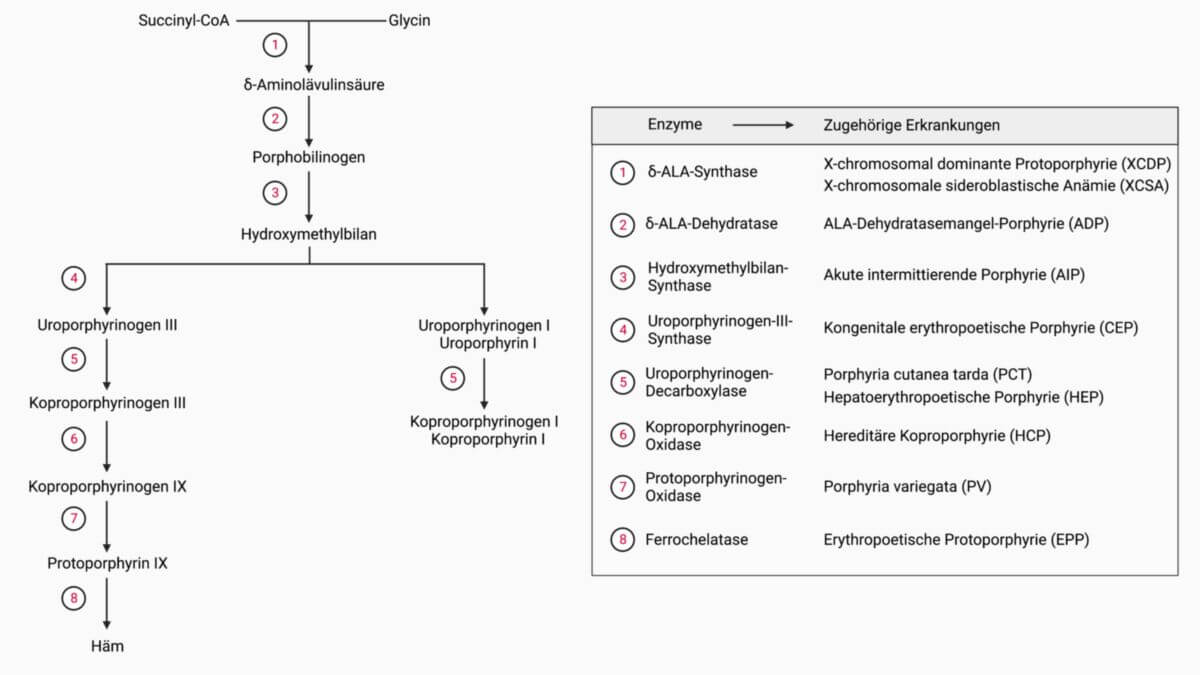
Die δ-Aminolävulinsäuredehydratase katalysiert den 2. Schritt der Porphyrinbiosynthese, die Umsetzung von zwei Molekülen δ-Aminolävulinsäure (δ-ALA) zu einem Molekül Porphobilinogen.
δ-Aminolävulinsäuredehydratase ist somit ein Schlüsselenzym für die Bildung von Hämoglobin und ein Zwischenprodukt der Hämsynthese.
Klinik
Der ALAD-Aktivität ist im Rahmen einer Bleivergiftung reduziert. Ab einem Blutbleispiegel von etwa 150 µg/l kommt es zu einer Hemmung des Enyzms. In der Folge lassen sich erhöhte ALA-Spiegel in Blut und Urin messen.
Ein ALAD-Mangel durch eine Mutation des ALAD-Gens führt zu einer Porphyrie. Dieses seltene Krankheitsbild wird als ALA-Dehydratasemangel-Porphyrie bezeichnet.