Anamorelin
Handelsname: Adlumiz® (Japan)
Definition
Anamorelin ist ein Arzneimittel zur Behandlung von ungewolltem Gewichtsverlust in Folge eines nicht-kleinzelligen Bronchialkarzinoms (NSCLC). Das Mittel ist derzeit (2025) in der EU nicht zugelassen.
Chemie
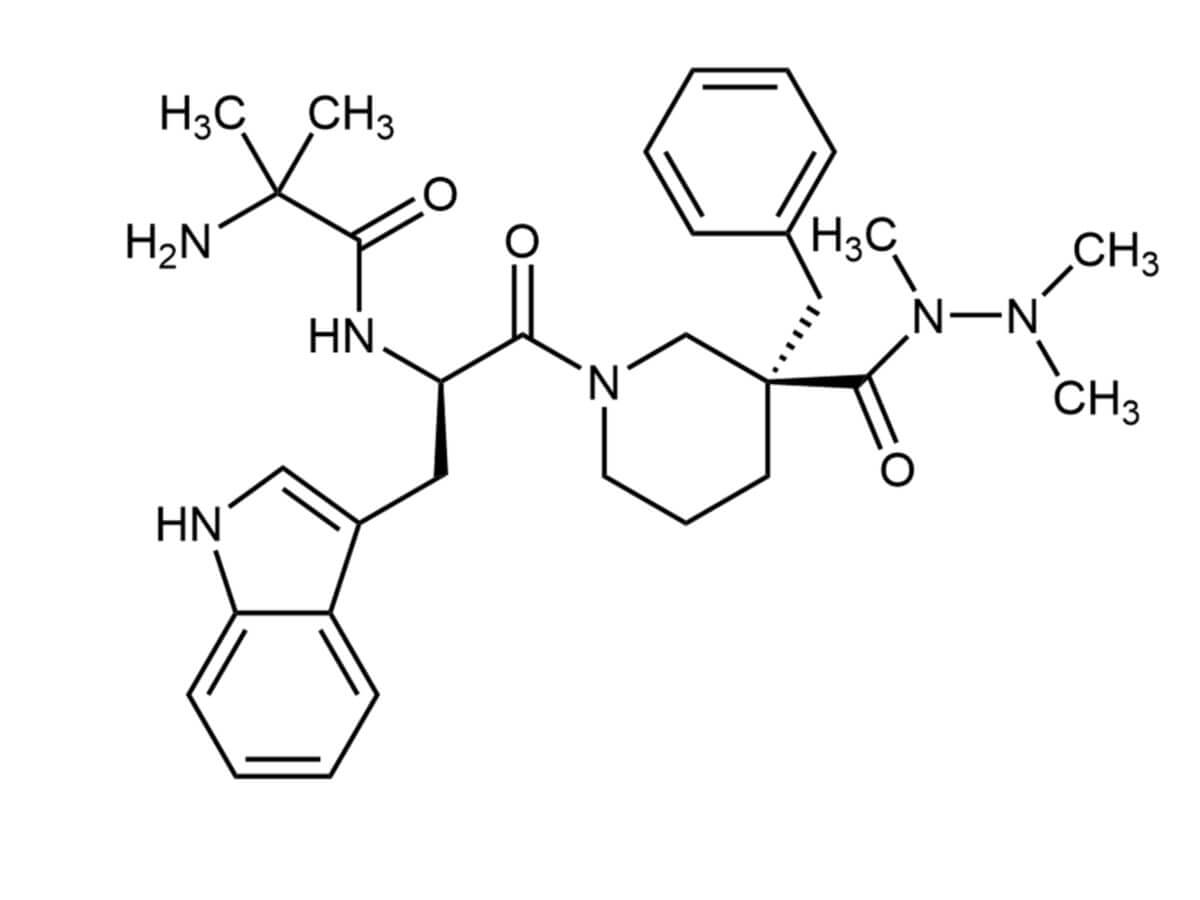
Anamorelin liegt pharmazeutisch als Anamorelinhydrochlorid vor. Es handelt sich um ein weißliches, hygroskopisches Pulver, das in polaren Lösungsmitteln wie Wasser, Methanol und Ethanol leicht löslich ist. Die Summenformel lautet C31H42N6O3.
Wirkmechanismus
Amorelin bindet an den Ghrelin-Rezeptor und aktiviert diesen. Dadurch werden die physiologischen Wirkungen von Ghrelin imitiert. Dies führt zu einer Steigerung des Appetits und soll einem Gewichtsverlust entgegenwirken.
Indikation
Nebenwirkungen
Zu den Nebenwirkungen zählen u.a.:
Zulassung
Der Ausschuss für Humanarzneimittel (CHMP) beschloss, dass der Nutzen von Anamorelin gegenüber den Risiken nicht überwiegt. Er empfahl deshalb im September 2017 die Versagung der Genehmigung für das Inverkehrbringen durch den Hersteller Helsinn Birex Pharmaceuticals Ltd.[1]
Quellen
- ↑ European Medicines Agency (EMA) Versagung der Genehmigung 15.09.2017