Lactatdehydrogenase
Englisch: lactate dehydrogenase
Definition
Die Lactatdehydrogenase, kurz LDH, ist ein ubiquitär vorkommendes Enzym, das die Oxidation von Lactat zu Pyruvat katalysiert. Diese Reaktion ist reversibel.
Vorkommen
Die Lactatdehydrogenase kommt in allen Zellen des menschlichen Organismus vor. Besonders hoch ist die Konzentration in der Herz- und Skelettmuskulatur, in der Leber, in Erythrozyten und Thrombozyten.
Struktur
Die Lactatdehydrogenase besteht aus vier Untereinheiten. Die einzelnen Untereinheiten zählen entweder zu den M-("Skelettmuskeltyp") oder H-Typ-Peptidketten ("Herzmuskeltyp"). Das Molekulargewicht beträgt ca. 140 kDa. Demnach ergeben sich fünf verschiedene Isoenzyme, die in spezifischen Konzentrationen in den jeweiligen Geweben zu finden sind:
- LDH 1: H4
- LDH 2: H3M1
- LDH 3: H2M2
- LDH 4: H1M3
- LDH 5: M4
Diese Isoenzyme katalysieren dieselbe Reaktion, unterscheiden sich aber sowohl in ihren physikalischen (Molekulargewicht, isoelektrischer Punkt, Denaturierungstemperatur), als auch in ihren katalytischen Eigenschaften (KM-Wert, pH-Optimum, Wechselzahl).
Reaktionsmechanismus
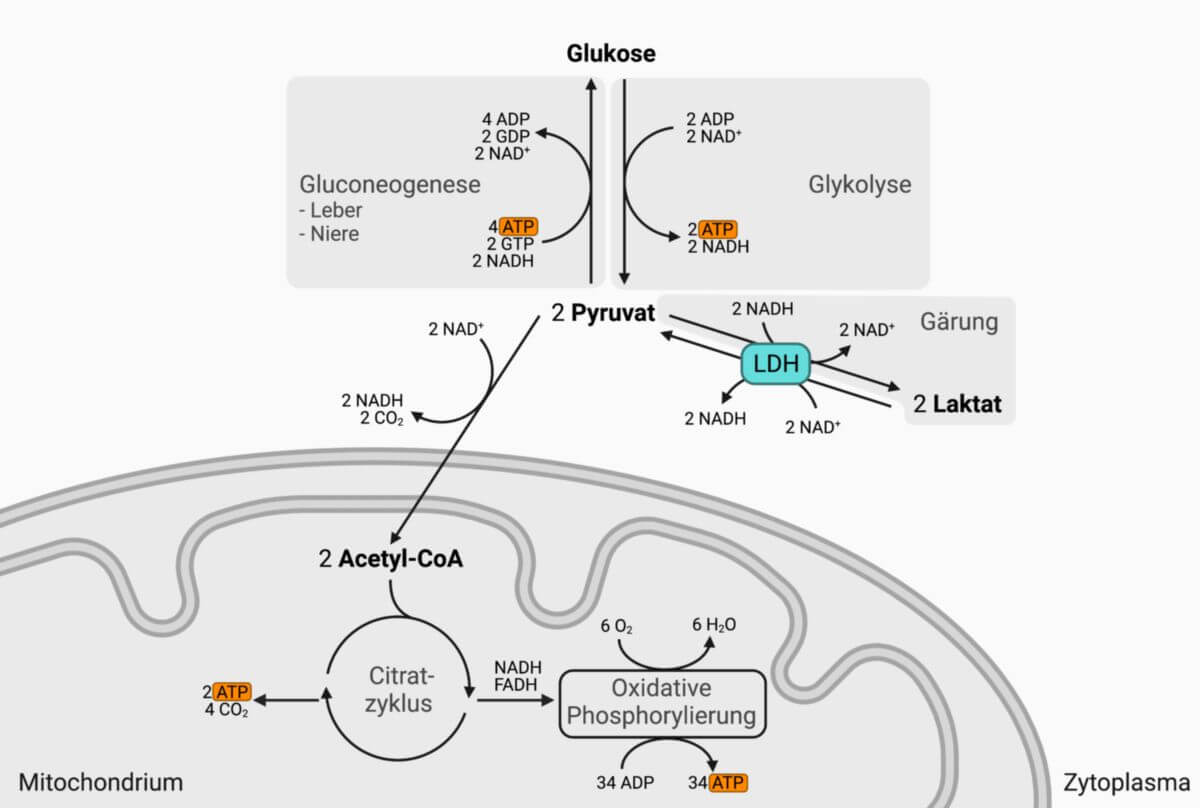
Die Lactatdehydrogenase katalysiert den letzten Schritt der anaeroben Glykolyse:
| Pyruvat + NADH + H+ ↔ Lactat + NAD+ |
Diese Reaktion kommt nur zustande, wenn die Sauerstoffkonzentration einer Zelle begrenzt ist, wie beispielsweise im kontrahierenden Skelettmuskel. Hier kann in der Atmungskette nicht genügend NAD+ aus NADH generiert werden, um die Glykolyse-Reaktionen aufrecht erhalten zu können. In diesem Falle kann die Zelle durch die Reduktion des Pyruvats zu Lactat auf schnelle Art und Weise NADH zu NAD+ oxidieren.
Ist genügend Sauerstoff vorhanden (wie beispielsweise im Herzmuskel), wird das Pyruvat in Acetyl-CoA umgewandelt und so in den Citratzyklus eingeschleust. Die Zelle gewinnt auf diesem Weg viel mehr ATP, als wenn das Pyruvat in Lactat umgesetzt wird.
Abhängig von diesen Umständen lässt sich die höhere Konzentration des Isoenzyms LDH 1 im Herzen und die von LDH 5 im Skelettmuskel erklären: Da die dauerhafte Kontraktion eines Skelettmuskels eine schnelle NAD+-Synthese erfordert, ist ein LDH-Isoenzym mit hoher Wechselzahl notwendig (M-Typ-Untereinheiten).
Im Herzen dagegen dominieren LDH 1 und 2 , die eine niedrigere Wechselzahl haben und deren Aktivität zusätzlich durch Pyruvat in physiologischen Konzentrationen gehemmt wird. Dadurch wird eine höhere Energiegewinnung durch Einschleusen des Pyruvats in den Citratzyklus gewährleistet. LDH 1 und LDH 2 werden zusammengefasst auch als Alpha-Hydroxybutyrat-Dehydrogenase bezeichnet und können für die Herzinfarkt-Diagnostik verwendet werden.
Diagnostische Bedeutung
Die Lactatdehydrogenase liegt im Serum in einer Konzentration von 90 bis 250 E/l vor; unter bestimmten pathologischen Konditionen jedoch kann der LDH-Level signifikant erhöht sein. Dies ist häufig der Fall, wenn in größerem Umfang Zellen zugrunde gehen, z.B. bei:
- Hämolyse
- Perniziöse Anämie
- myeloproliferativen Erkrankungen
- Myokardinfarkt
- Myokarditis
- Lungenembolie
- Virushepatitis
- Leberzirrhose
- Muskelerkrankungen
LDH wird als Hämolyseparameter und als unspezifischer Tumormarker verwendet. Eine Hämolyse in vitro kann ebenfalls eine LDH-Erhöhung verursachen.
Labormedizin
Material
Für die Untersuchung wird 1 ml Serum benötigt. Bei der Probenentnahme sollte eine Hämolyse vermieden werden, bei längerer Lagerung muss man die Proben nach der Blutentnahme abseren.
Referenzbereich
Messung bei 37 °C:
- Frauen: 135 bis 215 U/l
- Männer: 135 bis 225 U/l
Methode
Für die Untersuchung kommt ein enzymatischer Test zum Einsatz, bei dem eine kinetische Indikatorreaktion (Abnahme von NADH) bei 334, 340 oder 366 nm gemessen wird.