Keto-Enol-Tautomerie
von griechisch: tautó - das Gleiche und meros - Anteil
Definition
Als Keto-Enol-Tautomerie bezeichnet man in der Chemie das chemische Gleichgewicht zwischen zwei konstitutionsisomeren Formen eines Aldehyds oder Ketons. Dabei unterscheiden sich Keto- und Enolform in der Position eines H-Atoms und einer Doppelbindung.
Chemie
Um die Keto-Enol-Tautomerie zu verstehen, sind einige grundlegende Kenntnisse über Aldehyde und Ketone notwendig.
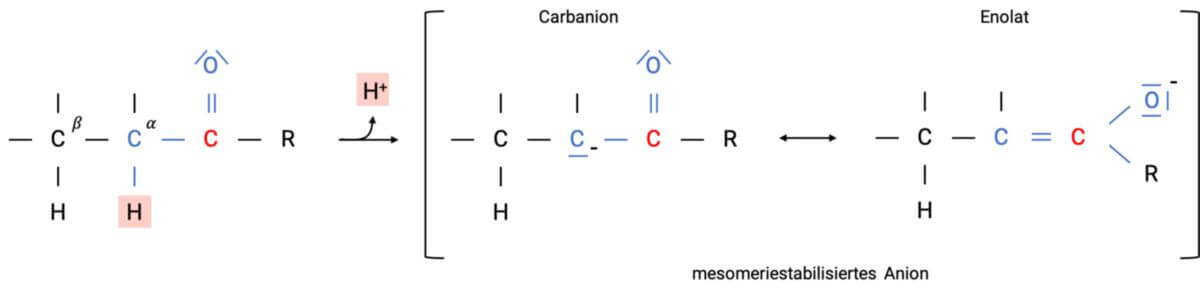
Deprotonierung am α-C-Atom
Da die Carbonylgruppe eine starke Polarisierung aufweist, strahlt diese auch auf das benachbarte Kohlenstoff-Atom aus. Das am α-C-Atom (α-ständiges C-Atom) gebundene Wasserstoff-Atom zeigt eine für C-H-Bindungen ungewöhnlich deutliche Azidität (pKs = 19-21 für Aldehyde und Ketone) und kann durch den Einsatz von starken Basen abgelöst werden. Als Auslöser gilt die Mesomeriestabilisierung des gebildeten Anions. Die negative Ladung des Elektronenpaars, das durch die vorhergehende Abspaltung frei geworden ist, verteilt sich zwischen dem α-C-Atom (Carbanion) und dem Carbonyl-O-Atom (Enolat-Ion). In der Realität liegt die Elektronen- und Ladungsverteilung zwischen diesen zwei Grenzformeln, jedoch tendieren sie aufgrund der Elektronegativität des Sauerstoffs deutlich zum Enolat.
Wiederanlagerung eines Protons
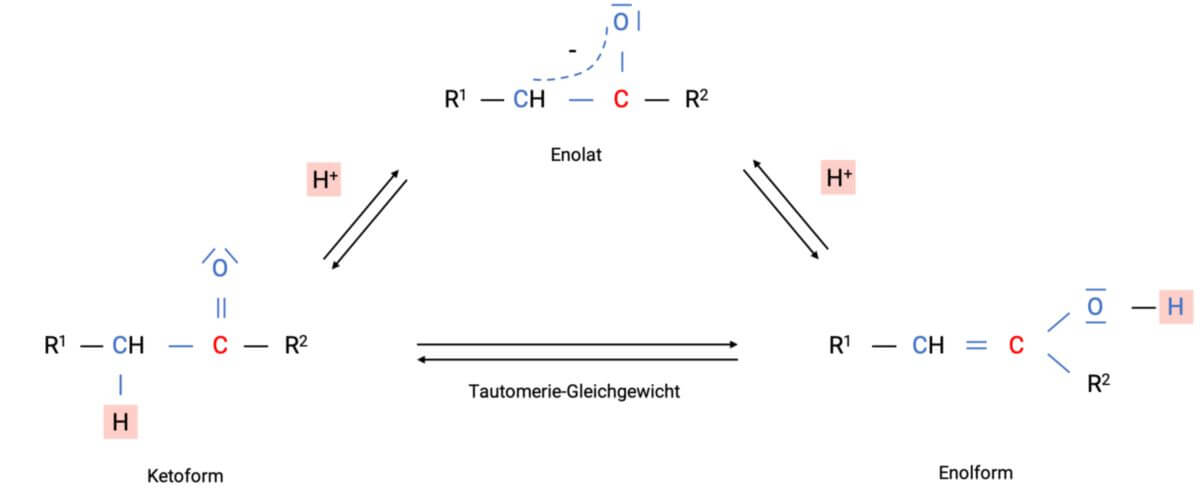
Je nach dem, welcher Reaktionspartner vorliegt, kann das System entweder als Carbanion oder als Enolat-Ion reagieren. Wird jedoch die alkalische Lösung angesäuert, hat das Anion zwei Möglichkeiten, ein Proton aufzunehmen: wird H+ an das α-C-Atom angelagert, so erhält man die Ketoform, lagert sich das Proton am Enolat-O-Atom an, resultiert die Enolform.
Die Bezeichnung "Ketoform" verwendet man in diesem Fall sowohl für Aldehyde als auch für Ketone. Zusätzlich verweist der Name "Enol" auf die C=C-Doppelbindung ("-en") mit anhängender OH-Gruppe ("-ol").
Tautomerie-Gleichgewicht
Sind die Aldehyde und Ketone als Flüssigkeiten verfügbar bzw. liegen sie gelöst vor, existieren gleichzeitig bei jeder Verbindung mit einem α-H-Atom sowohl die Keto- als auch die Enolform - weshalb sich ein Gleichgewicht einstellt. Da es sich bei der Keto- und Enolform einer Verbindung um sog. Konstitutionsisomere handelt, werden sie in diesem speziellen Fall als Tautomere bezeichnet. Daher spricht man bei der Gleichgewichtssituation von einem Tautomerie-Gleichgewicht. Ein solches Tautomerie-Gleichgewicht stellt sich in der Regel langsam ein, wobei Säuren oder Basen den Prozess auch katalysieren können. Genauer betrachtet, wandert dabei ein Proton von einem α-C-Atom zum O-Atom der Carbonylgruppe (bzw. in umgekehrter Reaktionsrichtung - ausgehend vom Enol). Im Zuge dessen ändert sich die Lage der Doppelbindung. Der Energiegehalt der einzelnen Tautomere ist für die anteilsmäßige Endsituation im Gleichgewicht zuständig. In der Regel überwiegt die Ketoform, es existieren jedoch auch Ausnahmen.
Literatur
- "Chemie für Mediziner" - A. Zeeck et. al., Urban & Fischer-Verlag, 7. Auflage