Acyl-CoA-Dehydrogenase
Englisch: Acyl CoA dehydrogenase
Definition
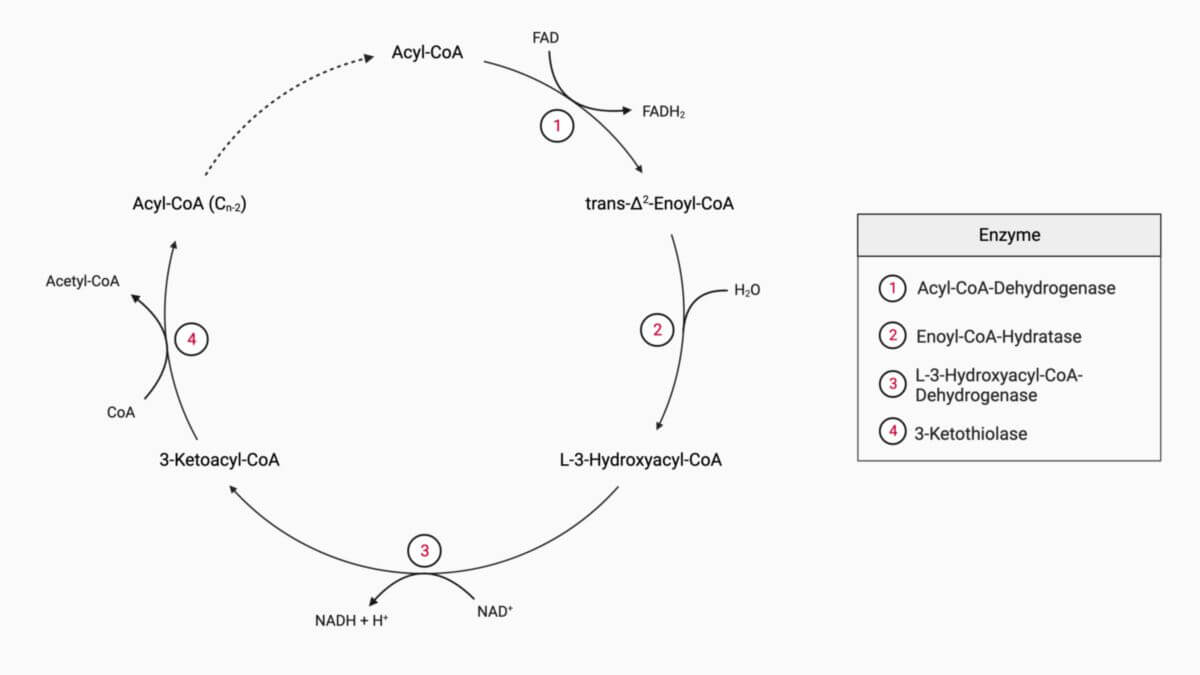
Die Acyl-CoA-Dehydrogenase ist ein mitochondriales Enzym, das den ersten Schritt der β-Oxidation, also den oxidativen Abbau von Fettsäuren, katalysiert.
Hintergrund
Das Prinzip der β-Oxidation und ihrer beteiligten Enzyme ist es, Fettsäuren in einem zyklischen Stoffwechselweg der mitochondrialen Matrix im Wesentlichen durch Oxidation abzubauen, d.h. Elektronen zu entziehen. Diese werden anschließend von der Atmungskette zum Aufbau des mitochondrialen Protonengradienten verwendet.
Biochemie
Enzym
Wie auch im Citratzyklus sind beim Abbau der Fettsäuren Dehydrogenasen die entscheidenden Enzyme. Es handelt sich bei der von der Acyl-CoA-Dehydrogenase katalysierten Reaktion um eine FAD-abhängige Oxidation (= Dehydrierung) von -CH2-CH2-Gruppen.
Reaktion
Der erste Schritt der β-Oxidation dient dem Einfügen einer Doppelbindung zwischen dem α- und β-C-Atom. Substrat ist das Acyl-CoA, dessen Acylgruppe zunächst nur eine Kette von -CH2-CH2-Einheiten aufweist. Um die Abspaltung des späteren Acetyl-CoA vorzubereiten, wird an der zukünftigen Spaltstelle eine Doppelbindung eingefügt. Die bei der Oxidation anfallenden Elektronen werden an das enzymgebundene FAD geheftet und in Form von FADH2 aufgefangen, das zur Atmungskette transportiert wird. Die der Doppelbindung benachbarten Gruppen zeigen in entgegengesetzte Richtung, d.h. sie stehen in trans-Stellung. Das Reaktionsprodukt enthält eine -HC=CH-Gruppe mit benachbarter Carbonylgruppe, d.h. eine Enoylgruppe, und wird deshalb als trans-Enoyl-CoA bezeichnet.
Klinik
Bei angeborenen Defekten der Acyl-CoA-Dehydrogenase kommt es zu Störungen beim Abbau von Fettsäuren.
siehe auch: Acyl-CoA-Dehydrogenase-Defekt
Literatur
Joachim Rassow et al.: Duale Reihe Biochemie, Thieme, 2. Auflage