AP-Endonuklease 1
Synonyme: Apurinic/Apyrimidinic Endodeoxyribonuclease 1, HAP1, REF1, APEX Nuklease
Definition
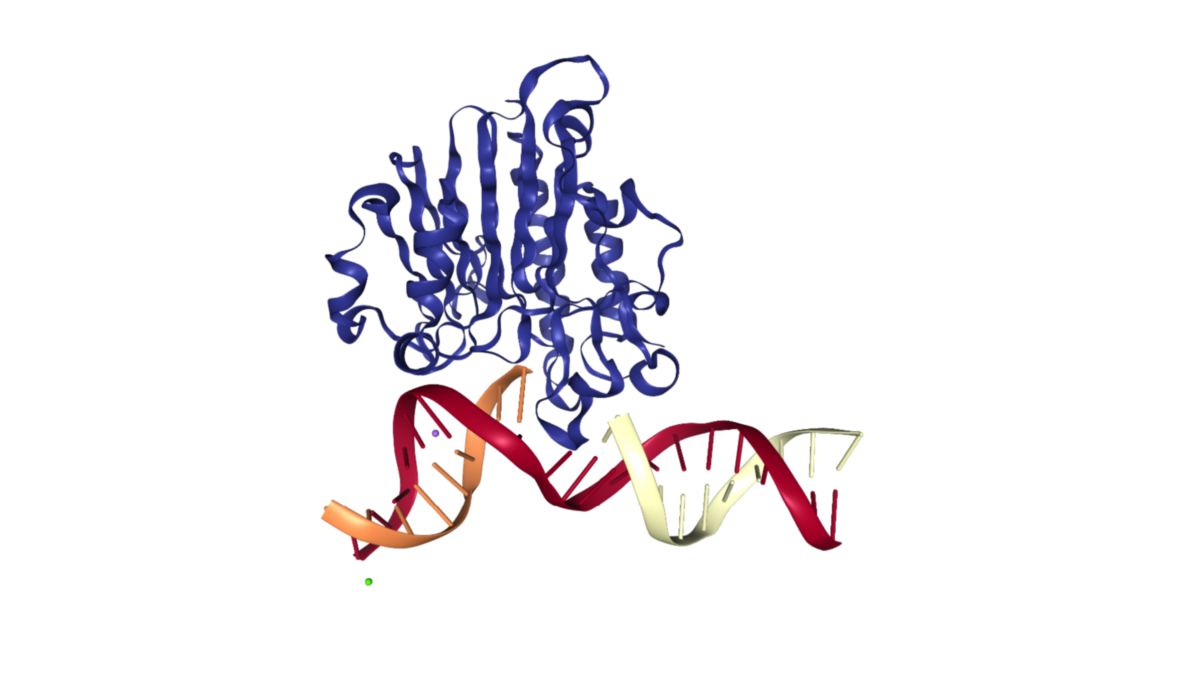
Die AP-Endonuklease 1, kurz APE1, ist eine Endonuklease, die das Phosphodiester-Rückgrat der DNA 5' von abasischen Nukleotiden ("abasic site") schneidet. Dies ermöglicht den Austausch beschädigter DNA-Basen während der Basen-Exzisionsreparatur.
Hintergrund
Bis zu 10.000 abasic sites entstehen jeden Tag in Säugetierzellen. Diese resultieren entweder aus spontaner Hydrolyse der N-glykosidischen Bindung oder durch Entfernung der Base durch spezifische Glykosylasen. Einige Glykosylasen sind bifunktional und können selber das DNA-Rückgrat einschneiden.
Genetik
APE1 wird beim Menschen durch das Gen APEX1 codiert. Es befindet sich auf Chromosom 14 am Genlokus q11.2 und besteht aus 5 Exons
Struktur
APE1 hat eine molekulare Masse von 35 kDa. Das Protein besitzt einen flexiblen N-Terminus und einen kompakten globulären C-Terminus. Letzterer ist für die Interaktion mit der DNA verantwortlich und zeigt die Endonukleasen-Aktivität. Diese Domäne nimmt eine Tertiärstruktur ein, die als α,β-Sandwich bezeichnet wird und charakteristisch für Nukleasen ist. Die Nukleasedomäne ist konserviert und zeigt eine Sequenzhomologie zur Endonuklease DNase1 und zur prokaryotischen Endonuklease ExoIII.[1]
Biochemie
APE1 erkennt abasische Stellen in der DNA und schneidet das Phosphodiester-Rückgrat der DNA durch Hydrolyse 5' der Beschädigung. Dies generiert einen Einzelstrangbruch mit einem 3'-OH- und einem 5'-Deoxyribosephosphat-Ende. Diese Lücke wird durch DNA-Polymerase β und Ligase III verschlossen.[2]
Die 3'-Phosphodiesterase-Aktivität von APE1 besitzt auch eine wichtige Funktion in der Reparatur von Einzelstrangbrüchen. Hier können beim Bruch des Stranges nicht legierbare 5'- und 3'-Enden entstehen. APE1 repariert hier 3'-Phosphoglycolat-Termini, die durch einen Zerfall der Desoxyribose entstehen können. Hierdurch entsteht ein kompatibles 3'-OH-Ende.[3]
Es konnte auch gezeigt werden, dass APE1 eine schwache 3'-Phosphatase, 3'–5-Exonuklease und RNaseH Aktivität besitzt. Ihre Rollen in der Zelle werden jedoch stark diskutiert.[4]
Quellen
- ↑ Dyrkheeva, N. S., Lebedeva, N. A. & Lavrik, O. I. AP Endonuclease 1 as a Key Enzyme in Repair of Apurinic/Apyrimidinic Sites. Biochemistry (Mosc) 81, 951-967, doi:10.1134/S0006297916090042 (2016).
- ↑ Abbotts, R. & Madhusudan, S. Human AP endonuclease 1 (APE1): from mechanistic insights to druggable target in cancer. Cancer Treat Rev 36, 425-435, doi:10.1016/j.ctrv.2009.12.006 (2010).
- ↑ Ende.Winters, T. A., Henner, W. D., Russell, P. S., McCullough, A. & Jorgensen, T. J. Removal of 3'-phosphoglycolate from DNA strand-break damage in an oligonucleotide substrate by recombinant human apurinic/apyrimidinic endonuclease 1. Nucleic Acids Res 22, 1866-1873 (1994).
- ↑ Abbotts, R. & Madhusudan, S. Human AP endonuclease 1 (APE1): from mechanistic insights to druggable target in cancer. Cancer Treat Rev 36, 425-435, doi:10.1016/j.ctrv.2009.12.006 (2010).