6-Phosphogluconolactonase
Synonyme: 6-Phospho-Gluconolacton-Hydrolase, "Lactonase"
Englisch: 6-phosphogluconolactonase
Definition
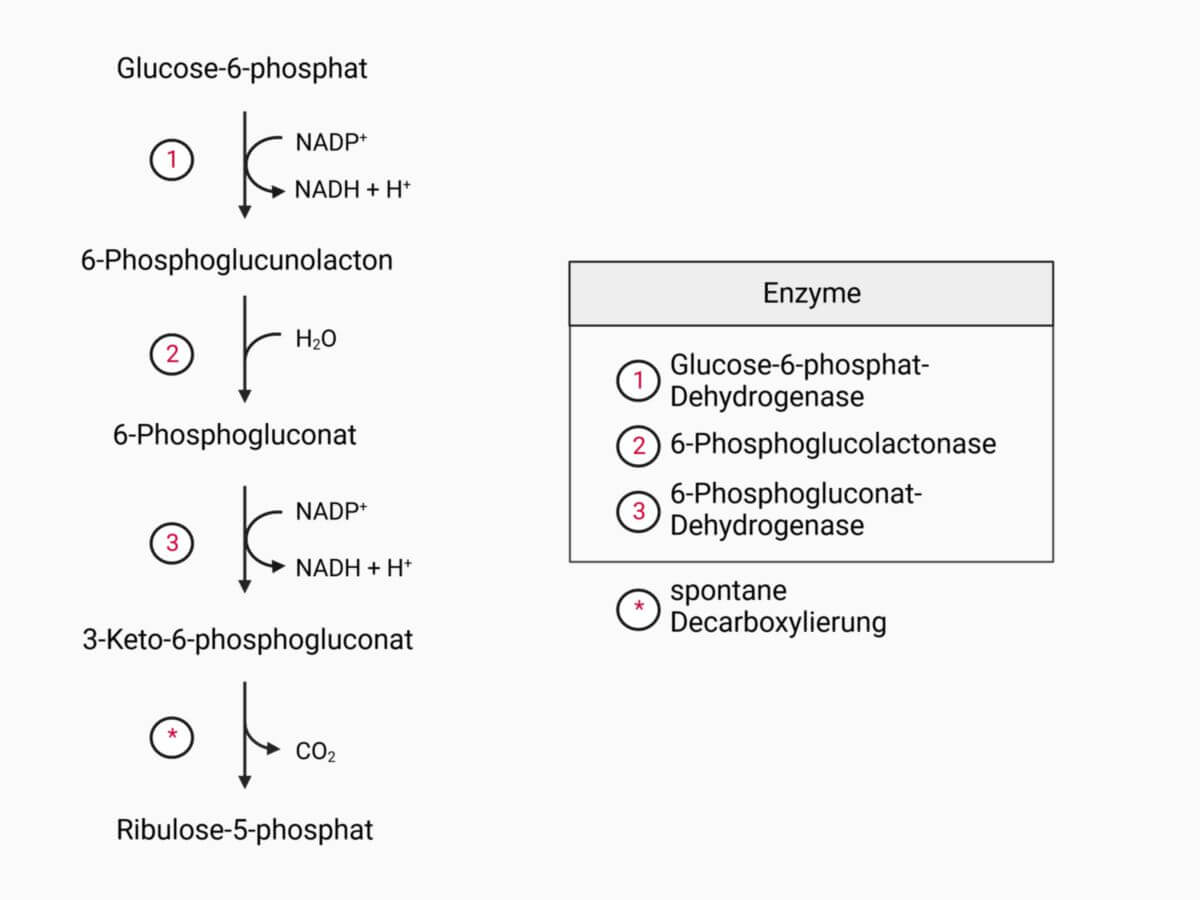
Die 6-Phosphogluconolactonase, kurz 6PGL, ist ein zur Gruppe III der EC-Klassifikation gehöriges Enzym, das die Hydrolyse von 6-Phosphogluconolacton zu 6-Phosphogluconat katalysiert. Sie ist somit Bestandteil des Pentosephosphatwegs.
Katalysierte Reaktion
Die 6-Phosphogluconolactonase katalysiert folgende Reaktion:
Struktur
Die 6-Phosphogluconolactonase besteht aus 258 Aminosäuren mit einer gemeinsamen Molekülmasse von rund 30 kDa. Die Tertiärstruktur des Enzyms weist eine α/β-Hydrolasefalte auf, die aus parallelen und antiparallelen β-Faltblättern, α-Helices und 310-Helices besteht. Die wesentlichen molekularen Strukturen des aktiven Zentrums sind Histidin- und Argininreste, wobei Histidin ein Proton beisteuert und Arginin die Ladung der Phosphatgruppe stabilisiert.
Klinik
Der Malariaerreger Plasmodium falciparum exprimiert ein bifunktionales Enzym, das sowohl die Aktivität der Glucose-6-phosphat-Dehydrogenase als auch der 6-Phosphogluconolactonase aufweist.[1] Dadurch kann der Erreger die ersten beiden Schritte des Pentosephosphatwegs katalysieren und die Aktivität dieses Stoffwechselwegs in den Erythrozyten vervielfachen. Das Enyzm ist ein mögliches Drug Target.
Quellen
- ↑ Clarke JL et al.: "Glucose-6-phosphate dehydrogenase-6-phosphogluconolactonase. A novel bifunctional enzyme in malaria parasites". European Journal of Biochemistry 2001, 268 (7): 2013–9. doi:10.1046/j.1432-1327.2001.02078.x. PMID 11277923