Sesselform
Synonyme: Sesselform-Schreibweise, Sesselkonformation
Englisch: chair conformation
Definition
Chemie
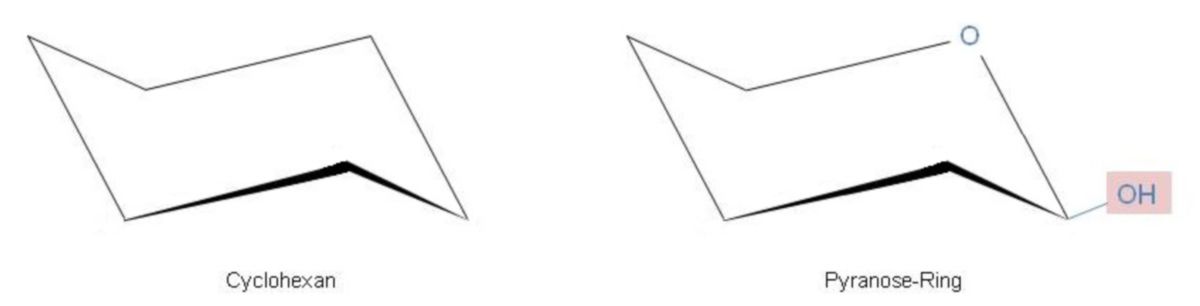
Die Haworth-Schreibweise bei Pyranosen gibt nur Auskunft über Konstitution und Konfiguration. Die Konformation des Sechsrings ist hierbei nicht ersichtlich. Somit fehlt also die Information über die räumliche Anordnung der Substituenten. Damit diese für den Betrachter ebenso erkenntbar ist, werden Pyranosen oftmals in der Sesselform aufgeschrieben.
Untersuchungen und die damit erlangten Röntgenstrukturdaten ergaben, dass sich der Sechsring mit dem Sauerstoffatom wie ein Cyclohexanring verhält und in der Regel die energetisch günstigere Sesselform einnimmt.
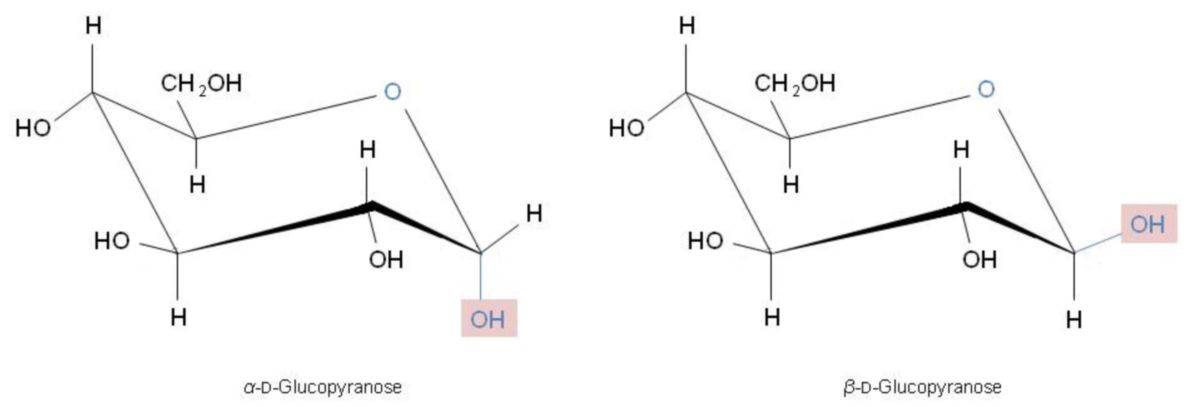
Der "Sessel" ist dabei so geklappt, dass möglichst viele Substituenten äquatorial stehen. Dies gilt besonders für die sperrige CH2OH-Gruppe an C-5. Die β-D-Glucopyranose weist beispielsweise nur äquatoriale (e, engl. equatorial) Substituenten auf. Hingegen beim α-Anomer steht die anomere OH-Gruppe an C-1 axial (a).
Schreibt man die β-D-Glucopyranose in der Sesselform auf, so erkennt man, dass alle Substituenten am Ring äquatorial (e) und damit benachbarte OH-Gruppen jeweils "trans" zueinander stehen (e,e-Anordnung = trans). Damit ist die Glucose das stabilste Molekül aus der Reihe der Aldohexosen, weshalb sie auch eine bedeutende Rolle in der Natur spielt. Bei Glucose und anderen Monosacchariden beobachtet man häufig für das anomere C-Atom, dass ein axiales OH (wie bei der α-Form der Glucose) die Konformation energetisch zusätzlich stabilisiert, was auf die Orbitalwechselwirkungen mit dem Sauerstoffatom im Ring zurückzuführen ist. Diese Tatsache bezeichnet man als anomeren Effekt.
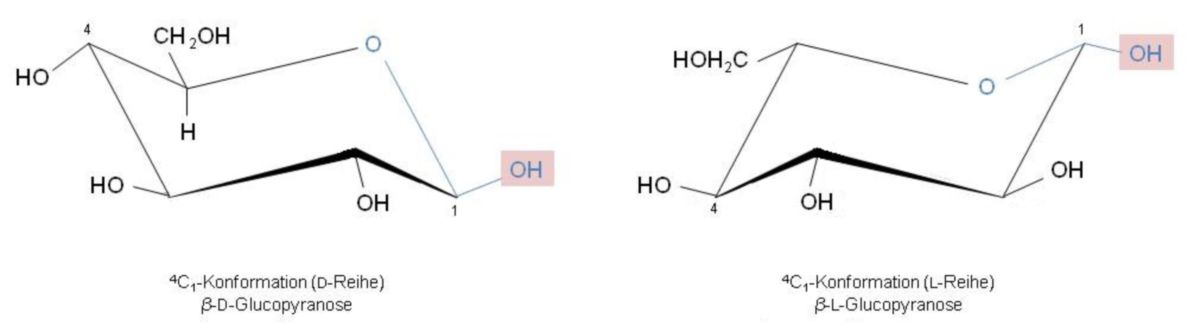
4C1-Konformation
Grundsätzlich wird der Pyranosering so aufgezeichnet, dass das Ring-O-Atom rechts hinten zu stehen kommt. Somit ist bei den wichtigen Monosacchariden der D-Reihe der Pyranose-Sessel so geklappt, dass C-4 oben und C-1 unten steht. Derartige Konformationen werden durch die Abkürzung 4C1 gekennzeichnet. Daher gilt: klappt man den Sessel um, liegt die 4C1-Konformation vor. Man schreibt so in der Regel die Monosaccharide der L-Reihe auf.
Folglich sind β-D- und β-L-Glucopyranose abgebildet, die zueinander enantiomer sind. Das heißt, dass alle Chiralitätszentren entgegengesetzt konfiguriert sind. Die β-Form kann man dadurch erkennen, dass die anomere OH-Gruppe auf der gleichen Seite der Ringebene steht wie die CH2OH-Gruppe: in der D-Reihe weisen diese nach oben, wohingegen sie in der L-Reihe nach unten zeigen.
Literatur
- "Chemie für Mediziner" - A. Zeeck et. al., Urban & Fischer-Verlag, 7. Auflage