Carbonsäureester
Definition
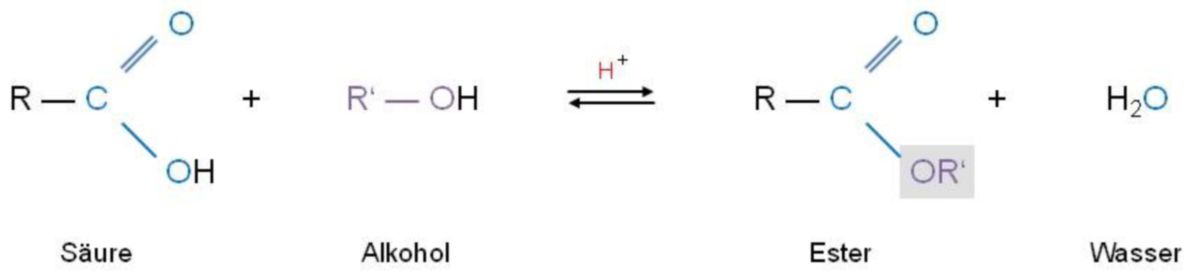
Carbonsäureester entstehen durch Alkoholyse reaktiver Säurechloride bzw. Säureanhydride oder auch aus einer direkten Reaktion von Carbonsäure mit Alkohol. Ihre allgemeine Formel lautet R1–CO–O–R2.
Chemie
Bei der direkten Bildung von Carbonsäureester aus Carbonsäure und Alkohol läuft die Reaktion nur sehr langsam ab und führt zu einem Gleichgewicht. Damit diese Gleichgewichtseinstellung schneller eintritt, verwendet man eine starke Säure (z.B. HCl, H2SO4) als Katalysator. Anschließend erhitzt man das Reaktionsgemisch. In diesem Vorgang ändert sich die Gleichgewichtslage, die durch die Gleichgewichtskonstante K ausgedrückt wird, nicht.
Um die Ausbeute an Ester zu erhöhen, kann das bei der Reaktion gebildete Wasser gebunden oder abdestilliert werden. Im umgekehrten Vorgang nutzt man diese säurekatalysierte Reaktion nicht nur für die Esterbildung (Hinreaktion), sondern auch zur Esterhydrolyse (Rückreaktion). So hydrolysiert ein Ester mit einem Überschuss an Wasser säurekatalysiert zur Säure und zum Alkohol.
| Massenwirkungsgesetz (MWG) bei der Esterbildung: |
|---|
Reaktionsmechanismus
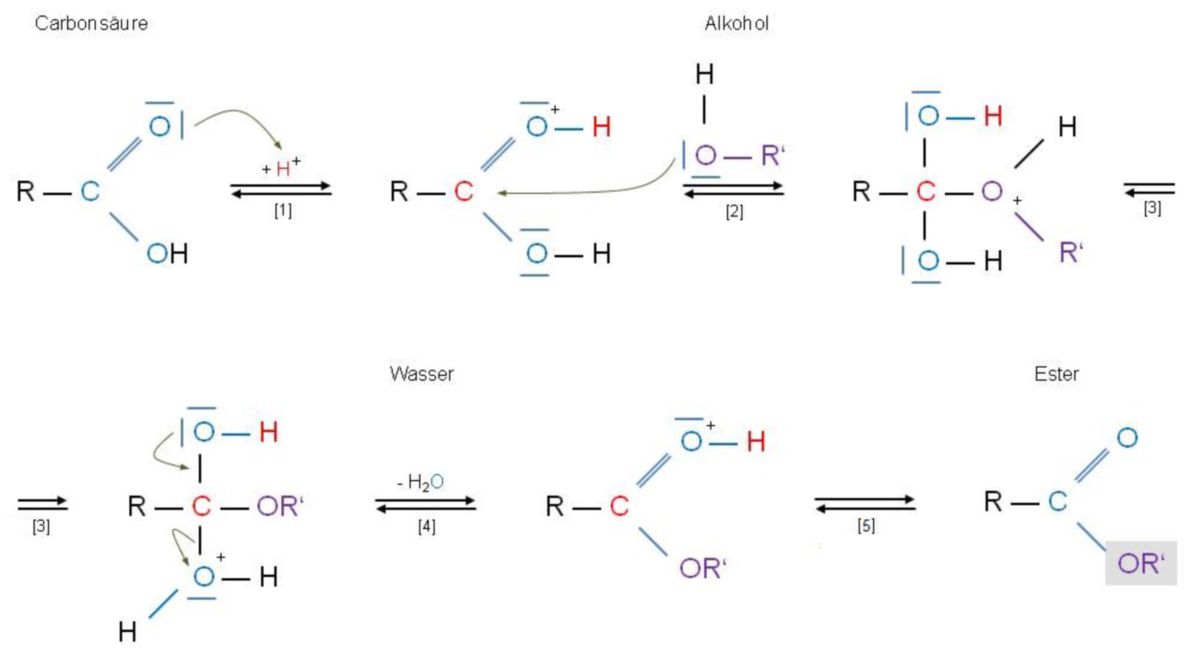
Die säurekatalysierte Veresterung führt über mehrere, z.T. sehr kurlebige Zwischenstufen. Alle Reaktionsschritte sind reversibel. Folgende Grafik beschreibt die Hinreaktion:
| Reaktionsschritte der Grafik: | |
|---|---|
| [1] | Der Katalysator protoniert das Carbonyl-O-Atom der Carbonsäure. |
| [2] | Das mittlerweile stark positiv polarisierte Carbonyl-C-Atom wird vom Alkohol nucleophil angegriffen. So verschieben sich die π-Elektronen zum Carbonyl-O-Atom, woraus ein tetraedrisches Zwischenprodukt entsteht. Letztlich fand eine Addition des Alkohols an die Carbonyl-Doppelbindung statt. |
| [3] | Vom Alkohol-O-Atom wird ein Proton auf das O-Atom der Carboxyl-OH-Gruppe verlagert. |
| [4] | Unter der Mitnahme des bindenden Elektronenpaares wird ein Wassermolekül vom C-Atom abgespalten, worauf sich die Carbonyl-Doppelbindung wieder ausbildet. Hier hat eine Eliminierung stattgefunden. |
| [5] | Schlussendlich verliert der protonierte Ester sein Proton. |
Bei der Hinreaktion fallen drei Dinge auf:
- Im Zuge der Reaktion wird der Katalysator H+ nicht verbraucht und verändert sich auch nicht (typisch für einen Katalysator).
- Das im gebildeten Wasser enthaltene O-Atom stammt ursprünglich aus der Carboxylgruppe der Carbonsäure.
- Die Gesamtreaktion basiert auf einem sog. Additions-Eliminierungs-Mechanismus, der über ein tetraedrisches Zwischenprodukt läuft. Hier wurde die OH-Gruppe der Carbonsäure durch die OR-Gruppe des Alkohols substituiert, weshalb eine Substitution am Carboxyl-C-Atom stattgefunden hat.
Literatur
- "Chemie für Mediziner" - A. Zeeck et. al., Urban & Fischer-Verlag, 7. Auflage