Tristetraprolin
Abkürzung: TTP, ZFP36
Englisch: Tristetraprolin, zinc finger protein 36 homolog
Definition
Tristetraprolin (TTP) ist ein ARE-bindendes Tandem-CCCH-Zinkfingerprotein. TTP wurde zuerst in Fibroblasten als Gen charakterisiert, welches schnell, aber kurzzeitig durch Wachstumsfaktoren und Mitogene induziert werden kann.
Funktion
TTP benötigt für die Erkennung seiner Ziel-mRNA „UUAUUUAUU-Nonamere“, welche sich in Klasse-II-AREs finden. In RIP-Chip-Analysen konnten aus einer TTP Immunpräzipitation (IP) LPS-stimulierter Makrophagen über 100 kodierende mRNAs identifiziert werden, die Ziel von TTP sind.
Untersuchungen an TNF-α mRNA zeigen, dass TTP die mRNA-Deadenylierung und 3’ → 5’-Degradierung der mRNA fördert. Weitere TTP regulierte mRNAs sind z.B. GM-CSF, Cyclooxygenase-2 (COX-2) und Interleukin-10 (IL-10). Außerdem scheint TTP auch die Stabilität seiner eigenen mRNA zu regulieren.
Regulation
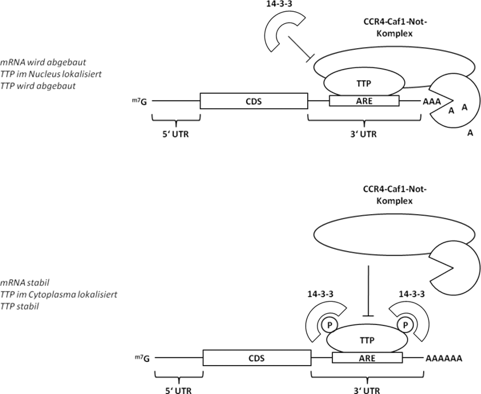
Ein wichtiger Faktor bei der mRNA-Stabilisierung durch TTP ist die Phosphorylierung von TTP durch die p38-aktivierte Kinase MK2. Im unphosphorylierten Zustand ist TTP selbst instabil und primär im Nukleus lokalisiert. Die Bindung von TTP an die ARE-tragende mRNA führt zu der Rekrutierung der einer Deadenylase (Ccr4-Caf1-Not Komplex) und dadurch zur Deadenylierung und Abbau der mRNA. Eine Phosphorylierung von TTP an Ser52 und Ser178 lässt Bindungsstellen für 14-3-3-Proteine entstehen. Diese Bindung stabilisiert zum einen TTP und verhindert gleichzeitig eine Rekrutierung des Ccr4-Caf1-Not-Komplexes. Somit wird die mRNA stabilisiert.
Die Bindung von TTP an die mRNA wird durch die Phosphorylierung nicht beeinflusst. Die Proteinphosphatase 2 (PP2A) sorgt durch Dephosphorylierung von TTP dafür, dass die 14-3-3-Bindung verloren geht, was dem Ccr4-Caf1-Not-Komplex die Möglichkeit gibt, die mRNA durch seine Bindung an TTP zu deadenylieren und somit zu destabilisieren.