Elektronenkonfiguration
Synonym: Elektronenverteilung
Englisch: electron configuration
Definition
Die Elektronenkonfiguration gibt an, wie die Verteilung der Elektronen in der Elektronenhülle eines Atoms auf den verschiedenen Energiezuständen bzw. Aufenthaltsräumen (Orbitale) ist.
Hintergrund
Die Elektronenkonfiguration folgt im Wesentlichen drei Regeln:
- Im Grundzustand eines Atoms erfolgt die Besetzung der Energieniveaus nacheinander, beginnend beim energieärmsten Niveau (1s).
- Die s-Unterniveaus werden vorab mit zwei Elektronen besetzt, bevor man mit der Besetzung des p-Unterniveaus derselben Schale beginnt.
- Die energetisch gleichwertigen p-Zustände (px, py, pz) werden zuerst nur mit einem Elektron besetzt. Diese drei weisen alle den selben parallelen Spin (Hund-Regel) auf. Anschließend kommt jeweils ein zweites Elektron mit entgegengesetztem Spin hinzu.
Anwendung
Die folgende Tabelle gibt die Elektronenkonfiguration der ersten 12 Elemente des Periodensystems (Ordnungszahl 1 bis 12) an. Die Anordnung ist entgegengesetzt aufgelistet: Sie erfolgt von unten nach oben, entsprechend dem Anstieg der Energieniveaus.
| Element | Symbol | Ordnungszahl | Elektronen- konfiguration |
Valenzelektronen |
| Magnesium Natrium Neon Fluor Sauerstoff Stickstoff Kohlenstoff Bor Beryllium Lithium Helium Wasserstoff |
Mg Na Ne F O N C B Be Li He H |
12 11 10 9 8 7 6 5 4 3 2 1 |
1s2 2s2 2p6 3s2 1s2 2s2 2p6 3s1 1s2 2s2 2p6 1s2 2s2 2p5 1s2 2s2 2p4 1s2 2s2 2p3 1s2 2s2 2p2 1s2 2s2 2p1 1s2 2s2 1s2 2s1 1s2 1s1 |
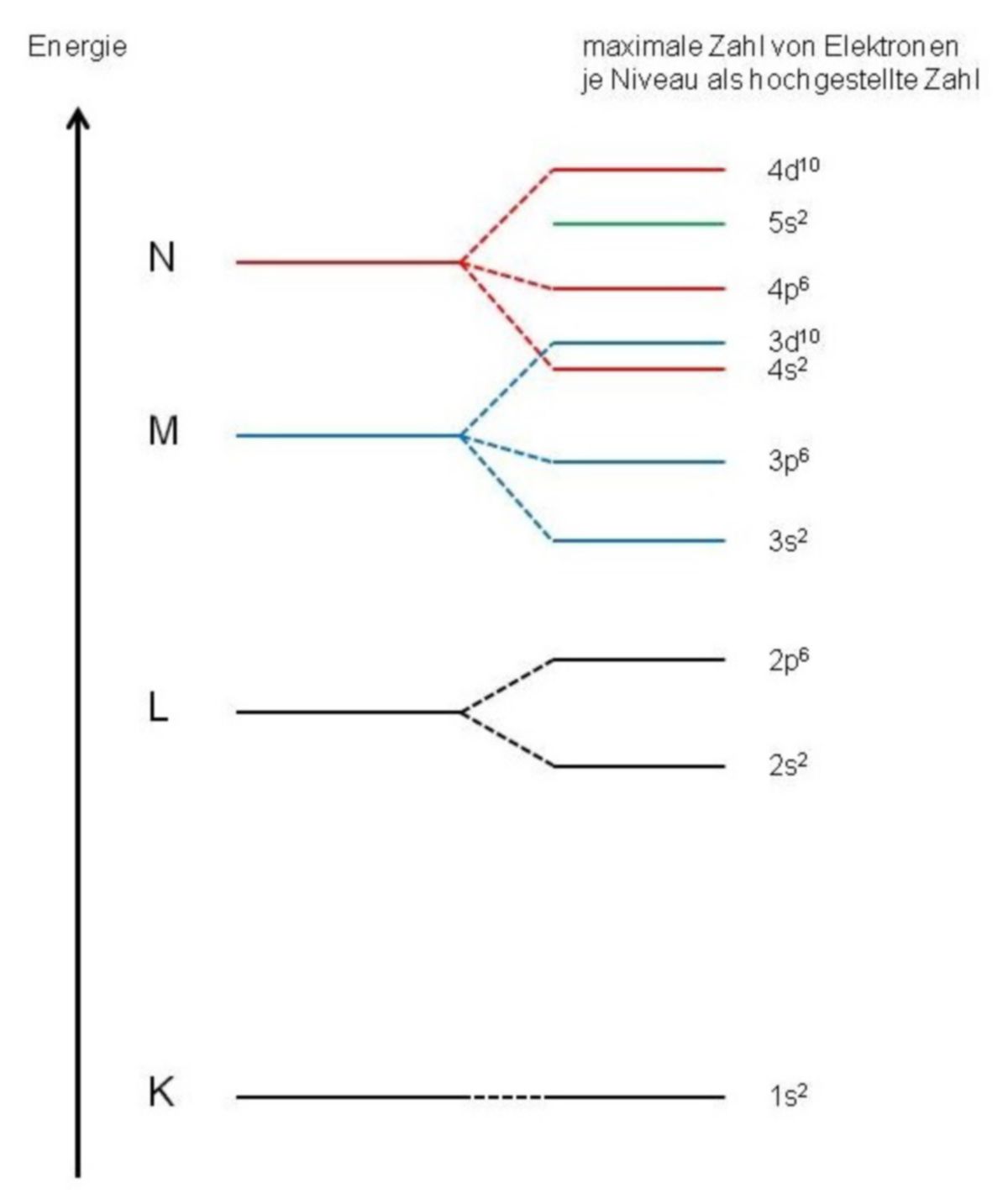
Energieniveauschema
Man kann gleichzeitig für die Elektronen eines Atoms die Energie der besetzten Niveaus kennzeichnen. Dazu benötigt man ein Energieniveauschema (Abbildung unten). Aus diesem kann man herauslesen, dass sich bis zum 3p-Niveau alles so ordnet, wie man es erwatet. Ab hier überschneiden sich die Energieniveaus der Schalen, da das 4s-Niveau energieärmer ist als das 3d-Niveau. So werden erst Elektronen in die 4. Schale eingebaut, bevor die restlichen Niveaus der 3. Schale aufgefüllt werden. Eine ähnliche Situation liegt beim 5s- und 4d-Niveau vor. In diesen Fällen sind die 4s- bzw. 5s-Elektronen die Valenzelektronen.
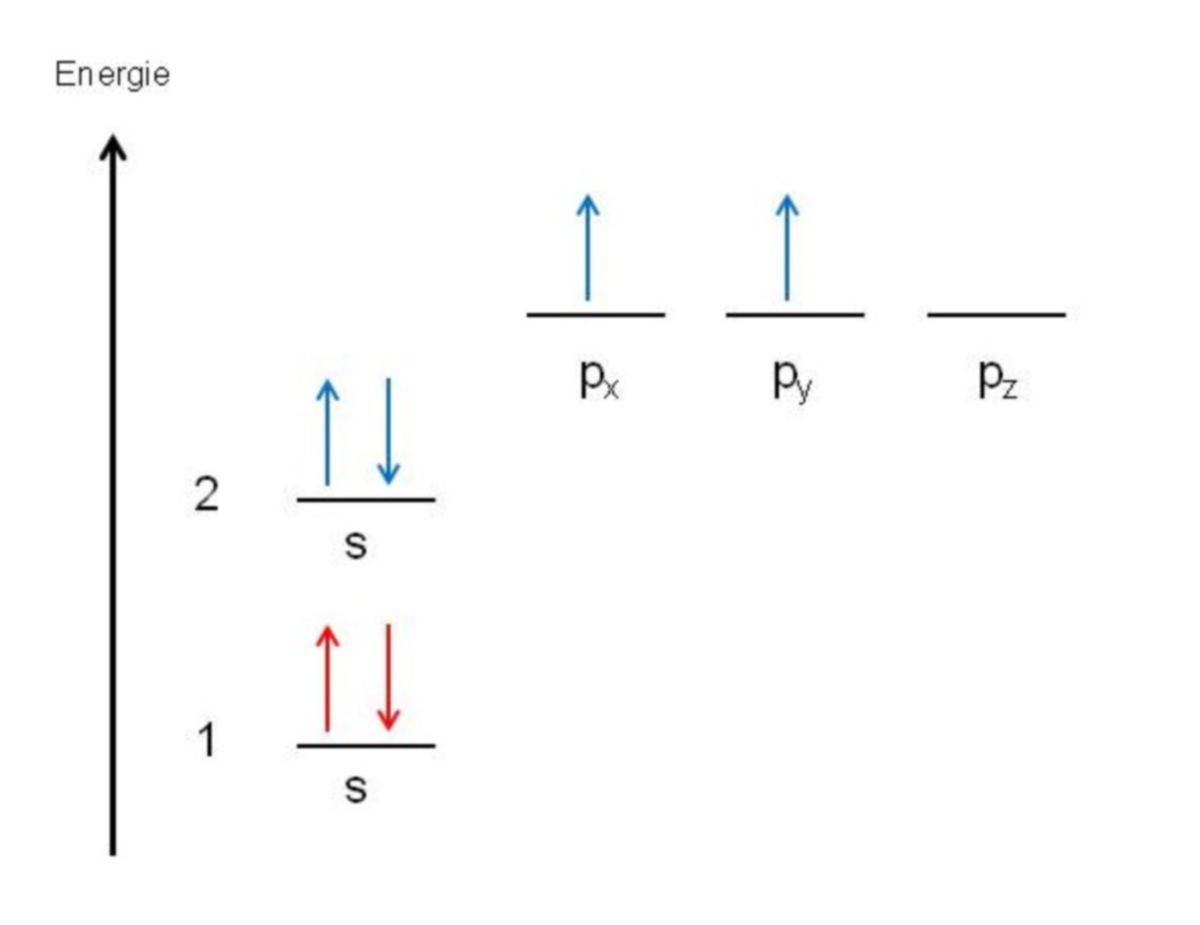
Als Beispiel folgt ein detailliertes Energieniveauschema für das Kohlenstoffatom. Die bei den Niveaus positionierten Pfeile kennzeichnen jeweils ein Elektron, durch die Pfeilrichtung wird der Spin des Elektrons charakterisiert. Das Kohlenstoffatom besitzt vier Valenzelektronen, die durch blaue Pfeile gekennzeichnet sind. Komplexer ist die Elektronenkonfiguration des Eisenatoms (26Fe) betrachen: 1s2 2s2 2p6 3s2 3p6 3d6 4s2. Das Eisenatom weist zwei Valenzelektronen auf. Das 3d-Niveau ist somit noch nicht voll aufgefüllt: Es fehlen also zur Vollbesetzung dieses Unterniveaus vier Elektronen.