Elektronenhülle
Synonyme: Atomhülle, Elektronenwolke
Englisch: electron shell, atomic cloud, principal energy level
Definition
Unter der Elektronenhülle versteht man den Teil des Atoms, der aus Elektronen besteht. Die Elektronenhülle ist keine feste, geometrisch fassbare Struktur, sondern lediglich ein mathematisch definierter Aufenthaltsraum der Elektronen, der mit Hilfe von schalen- oder hantelförmigen Orbitalen visualisiert wird. Die Struktur der Elektronenhülle bestimmt weitgehend die physikalischen und chemischen Eigenschaften eines Atoms.
Hintergrund
Seit Ernest Rutherford teilt man ein Atom in Atomhülle und Atomkern. Da die Elektronen eine geringe Masse aufweisen, besagt die Unschärferelation, dass die Hülle mehr als 10.000-mal größer ist als der Kern selber. Der Kern trägt typischerweise 4.000- bis 5.000-mal mehr zur Masse eines Atoms bei als die Hülle.
Bei einer chemischen Bindung, das heißt beim Ablauf chemischer Reaktionen, werden Elektronen umgeordnet. Ein Wissen über den Aufbau der Elektronenhülle und somit über die Zahl, die Energie und die räumliche Verteilung von Elektronen einzelner Atome ist in der Chemie unerlässlich.
Die in einem Atom enthaltenen positiv geladenen Atomkerne und negativ geladenen Elektronen üben eine Anziehungskraft aufeinander aus. Um ein Elektron vom Atomkern abzulösen muss deshalb auch Energie aufgewendet werden.
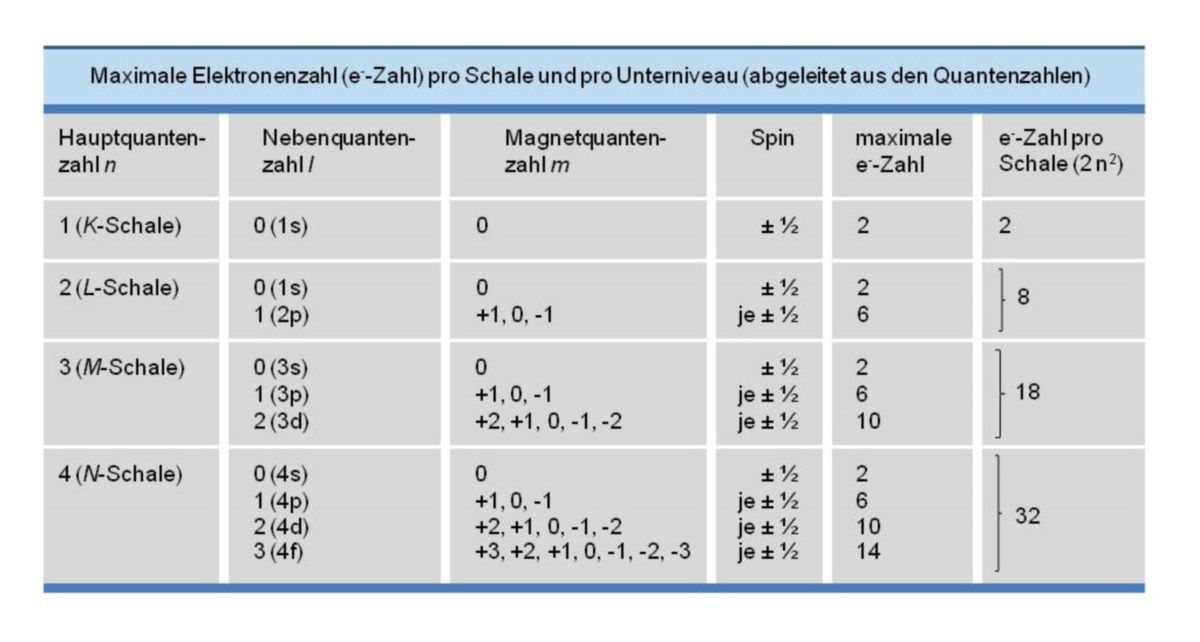
Quantenzahlen
Die Elektronen, die den Atomkern einhüllen, weisen nicht alle die gleiche Energie auf. Sie sind auf verschiedenen Energieniveaus aufgeteilt (Quantenzahlen).
Hauptquantenzahl
Es gibt mehrere Haupt-Energieniveaus (Schalen) der Elektronenhülle, die mit zunehmenden Abstand vom Atomkern durch folgende Buchstaben gekennzeichnet werden:
- K
- L
- M
- N, usw.
Elektronen der K-Schale befinden sich dichter am Atomkern und sind energieärmer als Elektronen auf der L- oder gar M-Schale. Alternativ dazu kann man an Stelle der Buchstaben auch von Hauptquantenzahlen (n) sprechen. Diese werden aufgsteigend gezählt:
- n = 1
- n = 2
- n = 2
- n = 4, usw.
Nebenquantenzahl
Man unterscheidet zusätzlich innerhalb eines Haupt-Energieniveaus (Hauptquantenzahl) für die Elektronen verschiedene Unterniveaus. Diese werden durch die Nebenquantenzahl (l) charakterisiert. Diese Zahl ist abhängig von der Hauptquantenzahl und reicht somit für jede Schale von l = 0 bis l = n - 1. Die Unterniveaus werden ebenfalls durch Buchstaben gekennzeichnet:
- s (l = 0)
- p (l = 1)
- d (l = 2)
- f (l = 3)
Die erste, und somit K-Schale enthält nur s-Elektronen, die L-Schale (2. Schale) s- und p-Elektronen und die M-Schale (Schale Nummer 3) s-, p- und d-Elektronen, usw.
Magnetquantenzahl
Die Nebenquantenzahlen werden mit Hilfe der Magnetquantenzahl m einer weiteren Aufspaltung unterzogen. m nimmt jeden Wert zwischen +l und -l (einschließlich 0) ein. Somit gilt z.B. für l = 0 ist m = 0. Das heißt, dass bei den s-Elektronen keine Aufspaltung des Niveaus vorliegt. Für l = 1 ist m = +1, 0 oder -1. p-Elektronen können drei verschiedene Zustände einnehmen (px, py und pz). Diese sind energetisch gesehen jedoch gleichwertig. Bei den d-Elektronen können fünf energetisch gleichwertige Zustände vorliegen: Für l = 2 gilt m = +2, +1, 0, -1 oder -2.
Spinquantenzahl
Neben den oben genannten Quantenzahlen gibt es noch ein letztes Unterscheidungsmerkmal für Elektronen: Die Spinquantenzahl, die der Drehrichtung eines Elektrons um seine eigene Achse entspricht und nur die Werte +½ und -½ annehmen kann. Somit wird ein einzelnes Elektron zu einem kleinen Magneten.
| Es gibt kein Elektron eines Atoms, das in allen vier Quantenzahlen mit einem anderen übereinstimmt (Pauli-Prinzip). |
|---|
Mit Hilfe der Quantenzahlen kann man die maximale Elektronenzahl für jedes Unterniveau und für jede Schale ableiten. Die maximale Elektronenzahl einer Schale beträgt 2 n2 - aus der zugehörigen Hauptquantenzahl n. Die Haupt- und Unerniveaus werden durch die Schreibweise 1s, 2s, 2p, 3s usw. gekennzeichnet. Ist eine zusätzliche Angabe der Elektronen auf einem Niveau erwünscht, so werden diese als Hochzahl geschrieben. Es ergibt sich folglich für die maximale Elektronenzahl der Niveaus:
- 1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s2, 4p6, usw.