Tislelizumab: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
|||
| Zeile 21: | Zeile 21: | ||
==Zulassung== | ==Zulassung== | ||
Der Wirkstoff ist seit September 2023 in Europa zugelassen. Er wurde vom Pharmaunternehmen [[BeiGene]] entwickelt. | Der Wirkstoff ist seit September 2023 in Europa zugelassen. Er wurde vom Pharmaunternehmen [[BeiGene]] entwickelt. Zulassungsinhaber in Europa ist [[Novartis]]. | ||
[[Fachgebiet:Arzneimittel]] | [[Fachgebiet:Arzneimittel]] | ||
[[Tag:Checkpoint-Inhibitor]] | [[Tag:Checkpoint-Inhibitor]] | ||
Version vom 22. Juli 2024, 13:56 Uhr
Handelsname: Tevimbra®
Synonym: BGB-A317
Definition
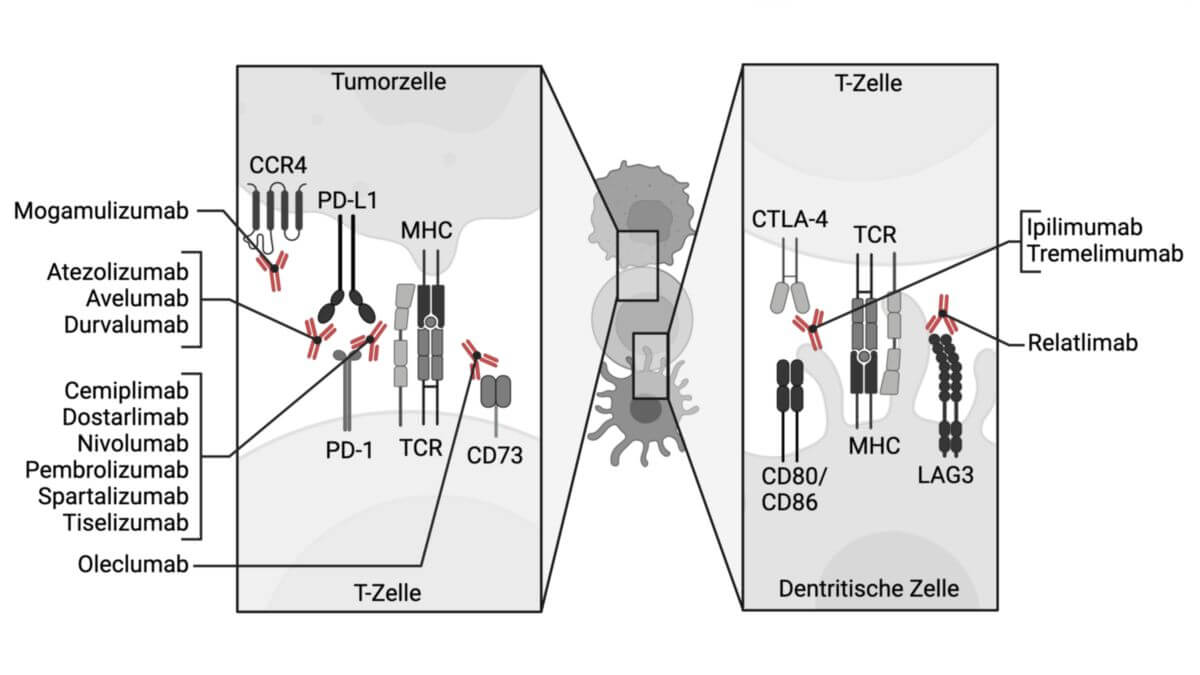
Tislelizumab ist ein Checkpoint-Inhibitor, der sich gegen PD-1 richtet und zur Therapie von soliden Tumoren (u.a. NSCLC) eingesetzt wird.
Biochemie
Tislelizumab ist ein monoklonaler Anti-PD-1-Antikörper. Er bindet an die extrazellulären Domänen des Transmembranproteins PD-1 auf Immunzellen.
Wirkmechanismus
Tislelizumab verhindert die Bindung der Liganden PD-L1 und PD-L2 an ihren Rezeptor. Die Aktivierung dieses Rezeptors fördert die immunologische Eigentoleranz, indem sie die Aktivität zytotoxischer T-Zellen dämpft. Die Hemmung des Rezeptors führt daher zu einer erhöhten Aktivität des Immunsystems gegen körpereigenes Gewebe und damit auch gegen das Tumorgewebe.
Indikationen
- Monotherapie des nicht resezierbaren, lokal fortgeschrittenen oder metastasierten Plattenepithelkarzinoms des Ösophagus nach vorheriger platinbasierter Chemotherapie bei erwachsenen Patienten.
Darreichungsformen
- Konzentrat zur Herstellung einer Infusionslösung