Substitutionsreaktion
von lateinisch: substituere - ersetzen
Englisch: substitution reaction, single displacement reaction, single substitution reaction
Definition
Bei Substitutionsreaktionen wird in einem Molekül ein Atom oder eine Atomgruppe durch ein anderes Atom oder eine andere Atomgruppe ersetzt.
Beispiel
Ein Beispiel für eine Substitutionsreaktion ist die Reaktion von Methan mit Brom zu Brommethan und Bromwasserstoff:
- CH4 + Br2 → CH3Br + HBr
Einteilung
Abhängig von den Reagenzien, die an der Reaktion beteiligt sind, werden in der organischen Chemie Substitutionsreaktionen in elektrophile und nukleophile Reaktionen eingeteilt, je nachdem, ob das Reagens, das die Substitution initiiert, elektrophil ("elektronenliebend") oder nukleophil ("kernliebend") ist.
Elektrophile Substitution
Elektrophile Substitutionsreaktionen (Symbol: SE) sind typisch für aromatische Verbindungen. Elektrophile sind Elektronenpaarakzeptoren, zu denen Lewis-Basen wie Carbeniumionen und andere Kationen, wie H+, zählen. Aromaten sind besonders durch Elektrophile angreifbar und wirken selbst nukleophil. Das π-Elektronen-Sextett der Aromaten stabilisiert ihre Struktur und erschwert somit die Aufbrüche und Überführungen der Doppelbindungen zu Einfachbindungen, was unter gewöhnlichen Umständen keine Additionsreaktion zulässt.
| Die typische Reaktion von Aromaten ist die elektrophile Substitutionsreaktion. |
Normalerweise wäre eine Doppelbindung energetisch ungünstiger als zwei Einfachbindungen. Da jedoch aufgrund der Ausrichtung der p-Orbitale der sp2-hybridisierten C-Atome über und unter der Ebene des aromatischen Rings, diese sich zu π-Elektronenwolken angleichen, erhöhen sie die Stabilität des Moleküls. Das macht ihren Zustand energetisch günstiger als den des Cyclohexans. Im Unterschied zur elektrophilen Addition bleibt bei SE-Reaktionen an aromatischen Verbindungen im Produkt die Anzahl der (Doppel-)Bindungen, somit die Anzahl der π-Elektronen und damit das energetisch günstigere aromatische System erhalten.
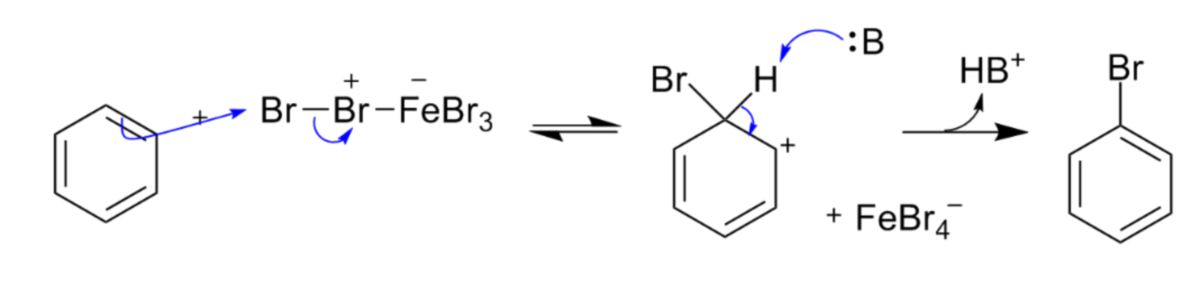
Anhand des Beispiels der Bromierung von Benzol können die einzelnen Reaktionsschritte betrachtet werden:
- Br+ (stark elektrophil) des Salzes FeBr3 [Eisen-(III)-bromid] greift Benzol an und bildet über einen Zwischenzustand eine σ-Bindung mit einem C-Atom des Ringes.
- Da dieser σ-Komplex die delokalisierten Molekülorbitale unterbricht und somit einen energiereicheren, energetisch ungünstigen Zustand schafft, stabilisiert sich der Komplex dadurch, dass ein H+-Ion austritt, wodurch das aromatische π-Elektronensystem wiederhergestellt wird.
- Das H+-Ion bildet schließlich den Katalysator zurück.
Nukleophile Substitution
Ein anderer Typ der Substitution ist die nukleophile Substitution (Symbol: SN). Hier reagiert ein Nukleophil in Form einer Lewis-Base als Elektronenpaardonator mit einer organischen Verbindung vom Typ R–X. R bezeichnet dabei einen Alkyl- oder Arylrest, X ein elektronenziehendes Heteroatom, das durch das Nukleophil ersetzt wird.
Vergleicht man die Reaktionsgeschwindigkeiten nukleophiler Reaktionen, findet man Unterschiede, die vom Substrat abhängen, das vom Nukleophil angegriffen wird. Hängt die Reaktion nur von der Konzentration des Substrates ab, handelt es sich um eine Reaktion 1. Ordnung, eine unimolekulare nukleophile Substitution (SN1-Reaktion). Hängt ihre Geschwindigkeit sowohl von der Konzentration des Substrates wie auch des Nukleophils ab, handelt es sich um eine Reaktion 2. Ordnung - es liegt eine bimolekulare nukleophile Substitution (SN2-Reaktion) vor.
| Die typische Reaktion von Halogenalkanen ist die nukleophile Substitutionsreaktionen. |
Voraussetzung für diese Reaktion ist eine größere Nukleophilie des Nukleophils Nu- als die der Abgangsgruppe X zum Erreichen eines energetisch günstigeren Systems.
| Merkhilfe: Entgegen ihres Namens, findet die SN1-Reaktionen in 2 Schritten, die SN2-Reaktion in einem Schritt (mit Übergangszustand) statt. |
SN1-Reaktion
Im ersten Schritt verlässt die Abgangsgruppe das sp3-hybridisierte C-Atom, wodurch ein Orbital unpaarig besetzt ist. Um einen energetisch günstigeren Zustand anzunehmen, bildet sich ein sp2-hybridisiertes Carbeniumion mit einem delokalisierten Elektron, das über die einzelnen Bindungen verteilt liegt, und ein Anion X-. Diese Dissoziation ist der geschwindigkeitsbestimmende Schritt der Reaktion:
R3C-X → R3C + + X-
Im zweiten Schritt wird das Carbeniumion vom Nukleophil angegriffen und ins Produkt überführt:
R3C+ + Nu- → R3C-Nu
Diese Reaktion findet an tertiären Kohlenstoffatomen statt, da alle drei ihrer Einfachbindungen zum nächsten C-Atom gleich stark und damit symmetrisch sind und der Aufbruch einer von ihnen energetisch aufwändiger wäre, als die Aufspaltung der asymmetrischen σ-Bindung zur Abgangsgruppe X.
SN2-Reaktion
Bei der SN2-Reaktion nähert sich das Nukleophil mit seinem freien Elektronenpaar dem sp3-hybridisierten C-Atom des Substrates von der "Rückseite" gegenüber der Abgangsgruppe. Bei dieser Annäherung wird ein instabiler Übergangszustand durchlaufen, bei dem Nukleophil und Abgangsgruppe gleichermaßen am C-Atom gebunden sind. Der Übergangszustand selbst stellt hierbei keine eigenständige Molekül-Zwischenstufe dar. Beide Reste benutzen ein Orbital, das im Übergangszustand dem Energieniveau des p-Orbitals eines sp2-hybridisierten Kohlenstoffs gleicht. Zu dem Zeitpunkt, zu dem die Abgangsgruppe mit ihrem Bindungselektronenpaar verlässt, "klappen" die unbeteiligten Orbitale und die damit verbundenen Substituenten wie ein Regenschirm um. Am Ende liegt wieder die Tetraedergeometrie eines sp3-C-Atoms vor.
SN2t-Reaktion
Der Additions-Eliminierungsmechanismus (Symbol: SN2t) ist ein Reaktionstyp der Organischen Chemie, der vor allem bei Derivaten von Carbonsäuren auftritt. Er läuft in Schritten ab, die denen der SN-Reaktion gleichen, weshalb er auch zu den Substitutionsreaktionen gezählt wird. Der Hauptunterschied besteht darin, dass das an der Reaktion teilnehmende C-Atom keine vier σ-gebundenen Atome/Reste aufweist, sondern zwei Einzelbindungen und eine Doppelbindung, meist zu Sauerstoff. Aufgrund der hohen Elektronegativität des Sauerstoffs, zieht es stärker am gemeinsamen Elektronenpaar als der Kohlenstoff, was dem Sauerstoff durch das "zusätzliche" Elektron eine negative und dem Kohlenstoff durch das "entrissene" Elektron eine positive Partialladung gibt. Durch diese positive Ladung wird es zum idealen Angriffsziel für Nukleophile. Zusätzlich wird, im Gegensatz zur SN-Reaktion, am Ende der Reaktion nicht die die tetraedische Molekülstruktur erreicht, sondern das Carbonyl daraus wieder regeneriert und folglich die sp2-Konfiguration des Eduktes wiederhergestellt.
- Im Schritt der Addition tritt das angreifende Nukleophil in das Molekül ein, indem es die Doppelbindung aufbricht und eine Einfachbindung mit dem C-Atom eingeht, wodurch ein Zwischenprodukt entsteht. Dabei werden zwei Elektronen der einen Sauerstoff-Kohlenstoff-Bindung vollständig zum Sauerstoff getrieben, wodurch der Sauerstoff negativ geladen wird.
- Im Schritt der Eliminierung wird das Zwischenprodukt unter Abspaltung der Abgangsgruppe stabilisiert. Dies erfolgt in den zwei Schritten der Eliminierungsreaktion, in denen sich die Kohlenstoff-Sauerstoff-Doppelbindung neu bildet. Dazu wird die Abgangsgruppe vom C-Atom abgespalten, um eine neue Bindung eingehen zu können.
Übersicht
- Befindet sich die austretende Gruppe an einem primären Kohlenstoffatom, findet ausschließlich eine SN2-Reaktion statt.
- Befindet sich die austretende Gruppe an einem sekundären Kohlenstoffatom, findet sowohl eine SN1- als auch eine SN2-Reaktion statt.
- Befindet sich die austretende Gruppe an einem tertiären Kohlenstoffatom, findet ausschließlich eine SN1-Reaktion statt.