Osmose
von altgriechisch: ὠσμός ("ōsmós") - Eindringen, Schub, Antrieb
Synonym: Behinderte Diffusion
Englisch: osmosis, adj. osmotic
Definition
Osmose bezeichnet die Diffusion einer Flüssigkeit bzw. eines Lösungsmittels durch eine semipermeable Membran. Die Flüssigkeit bewegt sich dabei immer zu der Seite, auf der die höhere Konzentration gelöster Teilchen vorliegt. Das entsprechende Adjektiv lautet osmotisch.
Prinzip
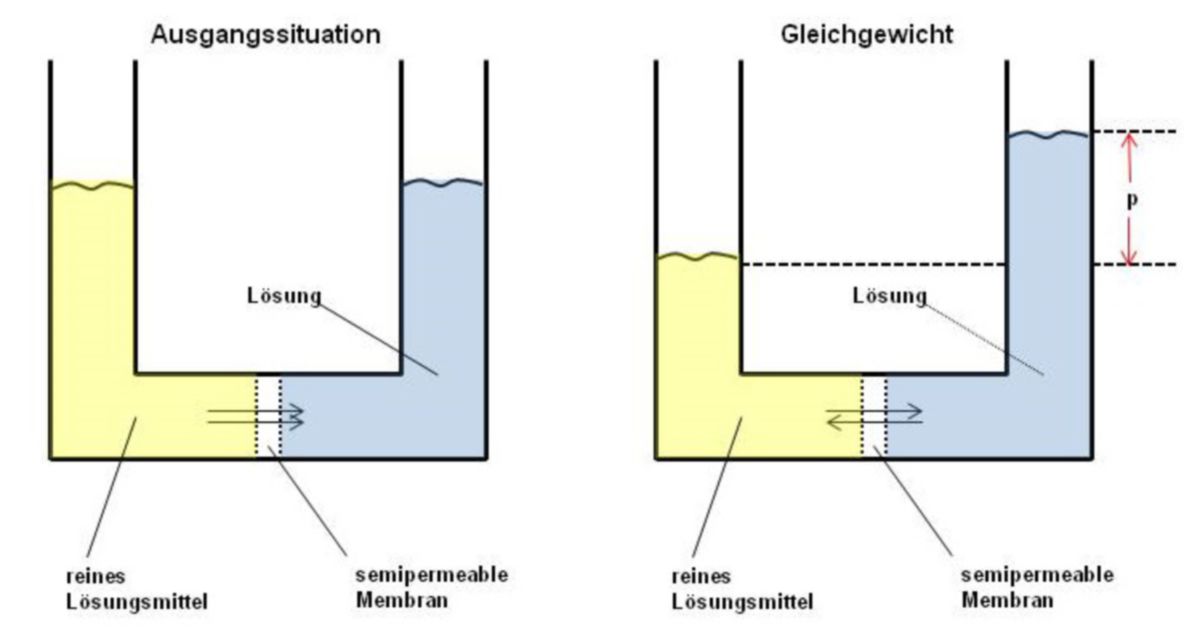
Die obige Abbildung zeigt das Prinzip der Osmose: reines Lösungsmittel (im biologischen Kontext meist Wasser) strömt von der linken Kammer in die rechte Kammer, um die dort vorhandene Lösung, die gelöste Teilchen (Substanz A) enthält, gemäß dem Konzentrationsgradienten zu verdünnen. Da Lösungsmittel einströmt, nimmt folglich das Volumen der Flüssigkeit in der rechten Kammer zu, während es in der linken Kammer abnimmt.
Da die Flüssigkeitssäule auf der rechten Seite ansteigt, wird ein Druck p (hydrostatischer Druck) erzeugt. Dieser Druck verursacht eine steigende Tendenz des Lösungsmittels, wieder zurück in die andere Kammer zu strömen und wirkt somit dem Verdünnungsbestreben entgegen.
Der Druck, der die Bewegung des Lösungsmittels durch die Membran antreibt, wird als osmotischer Druck (posm) bezeichnet. Er ist abhängig von der Temperatur und von der Konzentration der gelösten Substanz A.
| Formel | ||
|---|---|---|
| posm = [A] × R × T | [A] = Konzentration von Substanz A (in mol/L) R = allgemeine Gaskonstante (8,31 kPa × L × mol-1 × K-1) T = absolute Temperatur (in K) | |
Herrscht ein Gleichgewicht zwischen hydrostatischem und osmotischem Druck, ist die Zahl der in beide Richtungen diffundierenden Lösungsmittelmoleküle ausgeglichen.
Beispiel
Nehmen wir als gelöste Substanz ein Salz, so zerfällt dieses beim Lösen in zwei oder mehr Ionen. Der osmotische Druck der Lösung (hier Salzlösung) ist von der Anzahl der entstehenden Ionen abhängig, nicht etwa von der Ladung oder der Größe. Aus Kochsalz (NaCl) entstehen somit beim Lösen in Wasser zwei Ionen, Na+ und Cl-. Das heißt, dass aus 1 mol NaCl insgesamt 2 mol Ionen entstehen, aus 1 mol CaCl2 entsprechend 3 mol Ionen (Ca2+ und 2 Cl-).
Physiologie
Die Osmose spielt bei einer Vielzahl physiologischer Prozesse eine entscheidende Rolle. Hierzu zählen u.a. die Osmoregulation, die Exkretion und der Turgor.
Umkehrosmose
Übt man auf die Lösung auf den rechten Arm der rechten Abbildung einen Druck aus, der höher als der osmotische Druck ist, so wird ein Teilchenfluss aus der Lösung in das reine Lösungsmittel erzwungen. Dieser Vorgang wird als Umkehrosmose bezeichnet. Anwendung findet das zum Beispiel bei der Konzentration von Fruchtsäften, vor allem aber bei der Wasseraufbereitung und der Gewinnung von Wasser in Trinkqualität aus Salzwasser,. Dazu ist eine semipermeable Membran notwendig, die für Wassermoleküle durchlässig ist, jedoch nicht für hydratisierte Ionen. Dies ist dann der Fall, wenn der Durchmesser der Poren in der Membran kleiner als 5 Nanometer ist. Sogenannte Nanofilter mit einem Porendurchmesser von 10-100 nm halten die stärker hydratisierten, zweifach geladenen Ionen zurück, jedoch nicht die einfach geladenen Ionen - sie eignen sich somit zur Wasserenthärtung.