Konjugiertes Säure-Base-Paar
von lateinisch: coniungere - verbinden
Synonym: Korrespondierendes Säure-Base-Paar
Englisch: conjugate acids and conjugate bases
Definition
Hintergrund
Findet eine Säure-Base-Reaktion statt, bei denen Protonen übertragen werden, wird diese auch als Protolyse bezeichnet. Interessant ist jedoch, dass hier zu keiner Zeit freie Protonen (H+) existieren. Somit setzt jede Reaktion eines Partners als Säure zwingend die Gegenwart eines zweiten Partners als Base voraus. Das Proton der Säure muss ja schließlich übertragen werden (Definition nach Broensted). Ein System dieser Art wird auch korrespondierendes oder konjugiertes Säure-Base-Paar genannt, zwischen denen sich nach einer bestimmten Zeit stehts ein chemisches Gleichgewicht einstellt.
Allgemein
Findet eine Dissoziation einer Säure oder Base in Wasser statt, so ist dies eine Protonenübertragungsreaktion. Sowohl die Protonenaufnahme, als auch die -abgabe sind reversibel und laufen sehr schnell ab. Schlussendlich stellt sich wieder ein Gleichgewicht ein (Protolyse-Gleichgewicht).
| Beispiel Salzsäure: |
|---|
Anhand des Beispiels kann man erkennen, dass der eine Reaktionspartner (HCl) der Protonendonator (Säure A) ist, der andere (H2O) zwangsläufig der Protonenakzeptor (Base B). Betrachtet man die rechte Seite der Reaktionsgleichung, so ist das H3O+-Ion die Säure - es kann bei der Rückreaktion ein Proton abgeben (Säure B), und das Cl--Ion ist entsprechend die Base (Base A). Somit bezeichnet man das Cl- auch als konjugierte Base der Säure HCl, entsprechend ist H3O+ die konjugierte Säure der Base H2O. Somit gilt:
- HCl/Cl- und
- H3O+/H2O
sind konjugierte (korrespondierende, einander zugeordnete) Säure-Base-Paare.
konjugierten Säure-Base-Paare | |
| HA.. Säure H2O.. Wasser A-.. Anion |
Mehrprotonige Säuren
Neben einprotonigen Säuren, gibt es auch Säuren, die bei der Dissoziation in Wasser mehr als ein Proton abgeben können und entsprechend zweiprotonig (z.B. Schwefelsäure, H2SO4 und Kohlensäure, H2CO3) oder dreiprotonig (z.B. Phosphorsäure, H3PO4) sind. Liegt eine solche mehrprotonige Säure vor, existieren dementsprechend auch mehrere Dissoziationsstufen, die man nacheinander formuliert.
Anhand des folgenden Beispiels kann man erkennen, dass in der 1. Stufe die Schwefelsäure (H2SO4) die Säure und Hydrogensulfat (HSO4) die konjugierte Base ist. In der 2. Stufe hingengen stellt das Hydrogensulfat die Säure und Sulfat die konjugierte Base dar. Das Hydrogensulfat kann somit als Säure oder auch als Base fungieren.
| Beispiel Schwefelsäure: | |
|---|---|
| 1. Stufe: | |
| 2. Stufe: | |
| ad Stufe 1: | |
| ad Stufe 2: |
Basen
Wasser reagiert dann als Base, wenn eine Dissoziation von Säuren in Wasser stattfindet. Findet diese Reaktion jedoch in der Gegenwart der Base Ammoniakstatt, reagiert Wasser als Säure - entsprechend dem bekannten Dissoziationsgleichgewicht.
| Beispiel Ammoniak: | |
|---|---|
| NH3 + H2O ⇌ OH- + NH4+ | konjugierte Säure-Base-Paare: |
| Base B + Säure A ⇌ Base A + Säure B | NH4+/NH3 und H2O/OH- |
Somit steht fest: Für die Basen der allgemeinen Formel B, wobei das B mindenstens ein freies Elektronenpaar besitzen muss, gilt:
|
| |
Man kann sich merken, dass alle Säureanionen, die nach der Aufnahme von Protonen foglich wieder eine Säure werden, Basen sind. Dazu zählen auch die Alkali- und Erdalkalioxide (z.B. K2O), bei denen O2- die Base ist und durch die Aufnahme eines Protons aus dem Wasser zu OH- wird. Es handelt sich hierbei jedoch nicht um eine Dissoziation des Oxids, sondern um eine Reaktion des Oxids mit dem Wasser, das ein Proton abgibt:
- K2O + H2O ⇌ 2 K+ + 2 OH-
- CaO + H2O ⇌ Ca2+ + 2 OH-
Alkali- und Erdalkalihydroxide sind basisch und lassen sich auch in fester Form isolieren. Im Wasser erfahren sie eine Dissoziation wie folgt. OH--Ion ist hier die Base, das als Protonenakzeptor zur Verfügung steht.
Die Broensted-Definition besagt bekanntlich:
- Säuren geben Protonen ab, sie sind Protonendonatoren.
- Basen nehmen Protonen auf, sie sind Protonenakzeptoren.
Jedoch gilt diese Regelung nicht nur für wässrige Lösungen, sondern allgemein für Säure-Base-Reaktionen. Voraussetzung dafür ist jedoch, dass die Säure Protonen an eine Base abgeben kann. Dazu muss die Base mindestens ein freies Elektronenpaar besitzen, an das sich ein Proton anlagern kann.
| = |
Ampholyte
Bei der Dissoziation von Säuren und Basen haben wir also gesehen, dass Wasser gegenüber HCl als Base, gegenüber NH3 als Säure reagiert. Es ist somit amphoter.
| Stoffe, die amphotere Eigenschaften haben, heißen Ampholyte. Sie können sowohl Säure als auch Base sein und auch so reagieren. |
|---|
Es hängt also vom Reaktionspartner ab, wie das Wasser im Einzelfall reagiert. Somit kann man sich folgendes merken: Stößt das Wasser auf einen Stoff der eine größere Protonendonator-Stärke hat als es selbst, so reagiert es als Base. Als Gegenläufer reagiert Wasser mit der Base Ammoniak als Säure, da es eine größere Protonendonator-Stärke aufweist als dieses. Will man die Richtung von Säure-Base-Reaktionen vorhersagen, muss man die Protonendonator-Stärke messen. Anbei noch einige Beispiele für Ampholyte:
- H2O
- HSO4-
- HS-
- HCO3-
- H2PO4-
- HPO42-
Beispiel
Nehmen wir den Ampholyt H2PO4- einmal genauer in Betracht: Als Base kann er ein Proton aufnehmen, es entsteht H3PO4. Er ist aber zugleich in der Lage, ein Proton abzugeben, also als Säure zu reagieren. Es entsteht das zweifach negativ geladene Anion HPO42-.
| a.) H2PO4- + H+ ⇌ H3PO4 | b.) H2PO4- ⇌ HPO42- + H+ |
| ad a.) Dihydrogenphosphat + Proton ⇌ Phosphorsäure (reagiert als Base) |
|
| ad b.) Dihydrogenphosphat ⇌ Hydrogenphosphat + Proton (reagiert als Säure) |
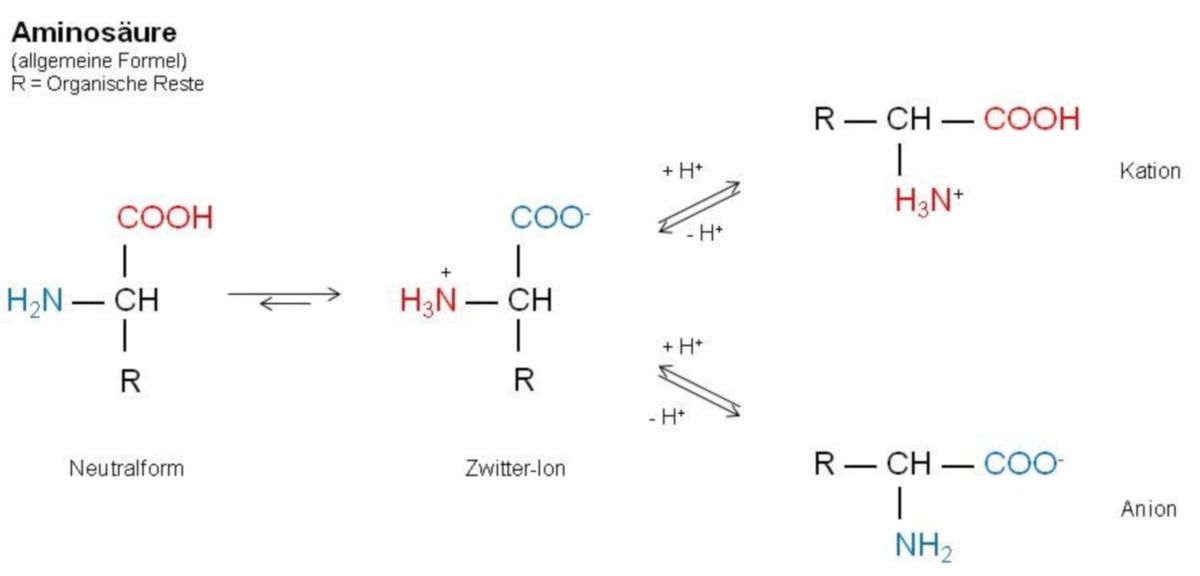
Zwitter-Ionen
Die Aminosäuren sind eine besondere Gruppe amphoterer Verbindungen, die im selben Molekül die saure COOH-Gruppe (Carboxygruppe) und die basische NH2-Gruppe (Aminogruppe) enthalten. Aminosäuren liegen zudem nicht in der Neutralform vor. Sie bilden in wässriger Lösung durch Proteolyse überwiegend das Zwitter-Ion. Diese Zwitter-Ion ist der eigentliche Ampholyt. Es kann wie folgt vorgehen: Es kann Protonen aufnehmen und wird somit zum Kation, eine zweiprotonige Säure oder es kann Protonen abgeben und wird so zum Anion.