Säure-Base-Titration
Synonym: Titrimetrie, Maßanalyse
Englisch: acid-base-titration
Definition
Die Säure-Base-Titration ist ein maßanalytisches Verfahren, das zur Bestimmung der Konzentration von Säuren und Basen in einer Lösung dient. Durch die allmähliche Zugabe einer Base zu einer Säure (auch Alkalimetrie genannt) oder umgekehrt - einer Säure zu einer Base (Azidimetrie), kann man auf die Konzentration zurückschließen. Diesen Vorgang bezeichnet man allgemein als Titration.
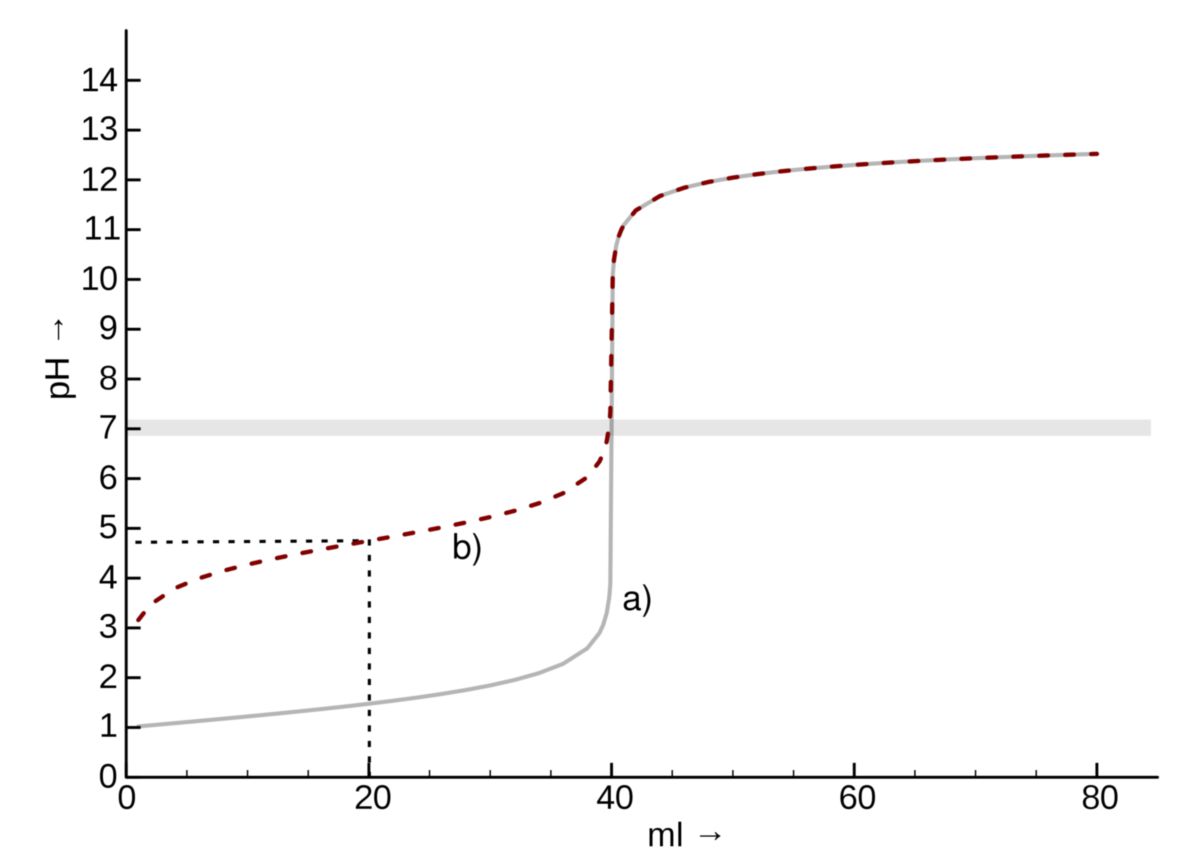
Titrationskurve
Die Titrationskurve einer pH-metrischen Titration zeigt eindeutig, dass der Übergang aus dem sauren in den alkalischen Bereich nicht allmählich, sondern plötzlich - in Form eines "pH-Sprungs" erfolgt.
Titration einer starken Säure
Man nehme eine 0,1 M HCl (starke Säure mit einem Anfangs-pH-Wert von 1) und versetze 10 ml davon nacheinander mit jeweils 1 ml 0,1 M NaOH. Dabei soll nach jeder Zugabe der pH-Wert bestimmt werden. Die gefundenen Werte sollen gegen das Volumen (ml) der zugegebenen NaOH graphisch aufgetragen werden. Nach dem Eintragen aller Werte erhält man eine Titrationskurve.
Wie man anhand der Grafik erkennen kann, überwiegt am Anfang die Salzsäure. Die Zugabe von NaOH wirkt sich zunächst nur wenig auf den pH-Wert der Lösung aus. Nach 90% verbrauchter vorgelegter Säure ist der pH-Wert erst von 1 auf 2 angestiegen. Nach 99% von 1 auf 3. Anschließend erfolgt ein kleiner Bereich, in dem die Zugabe sehr kleiner Mengen der Basenlösung (z.B. ein Tropfen) einen großen "pH-Sprung" verursacht (Stelle, an dem sich der senkrechte Kurvenast befindet). Nach genau 10 mL verbrauchter 0,1 M NaOH erreicht man den Äquivalenzpunkt. In unserem Beispiel liegt dieser Punkt genau bei pH = 7, also beim Neutralpunkt (dieser ist definitionsgemäß bei pH 7). Wird eine weitere Zugabe von Natronlauge vorgenommen, so bestimmt diese den pH-Wert der Lösung.
Titration einer schwachen Säure
Einen anderen Verlauf weist die Titrationskurve auf, wenn eine schwache Säure (z.B. 10 ml 0,1 M Essigsäure mit einem Anfangs-pH-Wert von 2,9) analog mit 0,1 M NaOH titriert wird. Diesmal liegt der Äquivalenzpunkt im Bereich um pH = 9. Er fällt also nicht mit dem Neutralpunkt zusammen. Charakteristisch für schwache Säuren ist zudem, dass der "pH-Sprung" am Äquivalenzpunkt nicht so drastisch ausfällt wie bei starken Säuren.
Gehaltsbestimmung durch Titration
Bei einer Titration werden Säuren oder Basen verwendet, die als Titrationsmittel bezeichnet werden. Deren Konzentrationen (z.B. in mol/L) müssen bekannt sein. Gelingt es einem, beim der ablaufenden Neutralisationsreaktion den Äquivalenzpunkt ausfinden zu machen, so ist es möglich, aus der bis dahin verbrauchten Menge Titrationsmittel (entweder eine Säure oder Base) den Gehalt an Säure bzw. Base in einer vorgegebenen Lösung zu berechnen. Um erkennen zu können, wann der Äquivalenzpunkt erreicht ist, nutzt man den Zeitpunkt des Farbumschlags eines Indikators.
Man muss bei der Auswahl des Indikators darauf achten, dass sein Umgschlagbereich verständlicherweise im pH-Bereich des senkrecht aufsteigenden Kurvenastes der Titrationskurve liegt. Betrachtet man das Beispiel mit der starken Säure (HCl) mit NaOH, so weiß man, dass mehrere Indikatoren geeignet wären (z.B. Methylorange). Bei der schwachen Säure Essigsäure hingegen kommt praktisch nur Phenolphthalein (Umschlagbereich: pH 8,2 - 10) in Frage. Würde man beispielsweise als Indikator Methylorange nehmen (Umschlagbereich: pH = 3-5) , so würde der Farbumschlag vor Erreichen des Äquivalenzpunktes eintreten - die Gehaltsbestimmung wäre fehlerhaft.
Titriert die oben genannten Säuren (HCl oder Essigsäure) mit einer 0,1 M NaOH (Gehalt: 0,1 mol/l), braucht man bei der Titration lediglich das Volumen der zugegebenen Natronlauge zu messen. So weiß man zu jedem Zeitpunkt, welche Menge NaOH (in mol) verwendet und somit verbraucht wurde.
Beispiele
- Der menschliche Magensaft enthält bekanntlich Salzsäure. Wenn eine vorgelegte Menge Magensaft mit unbekanntem HCl-Gehalt bis zum Äquivalenzpunkt 20 ml 0,1 M NaOH verbraucht, wurden so 0,02 l · 0,1 mol/l = 0,002 mol (2 mmol) NaOH hinzugefügt. Da Säure und Base in äquivalenten Mengen reagieren, müssen somit folglich auch 0,002 mol (2 mmol) HCl in der Magensaftprobe vorgelegen haben. Soll darüber hinaus herausgefunden werden, wie viel mg HCl dies sind, benötigt man lediglich die Molmasse von HCl (36,5 g/mol). Somit errechnen sich für 2 mmol HCl 73 mg HCl (2 mmol · 36,5 mg/mmol).
- Es ist eine Lösung vorgegeben, deren Gehalt bestimmt werden soll. Jene enthält jetzt Schwefelsäure (H2SO4), eine zweiprotonige Säure. Will man eine quantitative Bestimmung durchführen, muss beachtet werden, dass 1 mol H2SO4 in Wasser insgesamt 2 mol Hydronium-Ionen bildet. Es wird angenommen, dass bis zum Erreichen des Äquivalenzpunktes wiederum 20 ml 0,1 M NaOH verbraucht wird. So müssen 2 mmol H3O+-Ionen vorgelegen haben, die aus 1 mmol H2SO4 (Molmasse: 98 g/mol) entstanden sind. Die Lösung enthält also 98 mg H2SO4.
Normallösung
Liegen mehrprotonige Säuren bzw. mehrbasige Hydroxide vor, so verläuft eine Titration analog zu einer einprotonigen Säure oder Base. Nur bei der Berechnung des Gehalts einer Lösung an Säure bzw. Base muss man einen Faktor berücksichtigen, der der Zahl der abspaltbaren Protonen bzw. Hydroxid-Ionen entspricht. Als Beispiel soll der Faktor 2 bei der Schwefelsäure genannt werden. Damit dies nicht vergessen wird, verwendet man sogenannte Normallösungen. Nehmen wir als Beispiel eine 1 N Schwefelsäure zur Hand: In einem Liter enhält sie so viel H2SO4 wie ihrer Äquivalentmasse in Gramm entspricht. Die Äquivalentmasse setzt sich aus der Molmasse, geteilt durch die Anzahl der abspaltbaren Protonen zusammen. So gilt für die Schwefelsäure 98 ÷ 2, also 49 g. Der Gehalt (49 g) entspricht somit der Äquivalentkonzentration. Liegen einprotonige Säuren vor (z.B. HCl), so haben molare und normale Lösungen denselben Gehalt. Das selbige gilt für 1 M oder 1 N NaOH.