Hückel-Regel
nach dem deutschen Chemiker Erich Hückel (1896-1980)
Englisch: Hückel's rule
Definition
Durch die Hückel-Regel kann man feststellen, ob es sich bei einer vorliegenden chemischen Verbindung um ein aromatisches Molekül handelt, oder nicht. Diese Regel kann man aus der umfassenden Hückel-Näherung ableiten.
Regel
Liegt ein zyklisch durchkonjugiertes Molekül mit [4n+2] π-Elektronen - also einer ungeraden Zahl von Elektronenpaaren - vor, so ist dieses besonders stabil und wird deshalb auch als Aromat bezeichnet.
| Beispiele: | ||
|---|---|---|
Liegt jedoch ein Molekül mit [4n] π-Elektronen - also einer geraden Zahl von Elektronenpaaren - vor, so ist diese Verbindung instabil und wird deshalb auch als Antiaromat bezeichnet.
| Beispiele: | ||
|---|---|---|
Beispiele
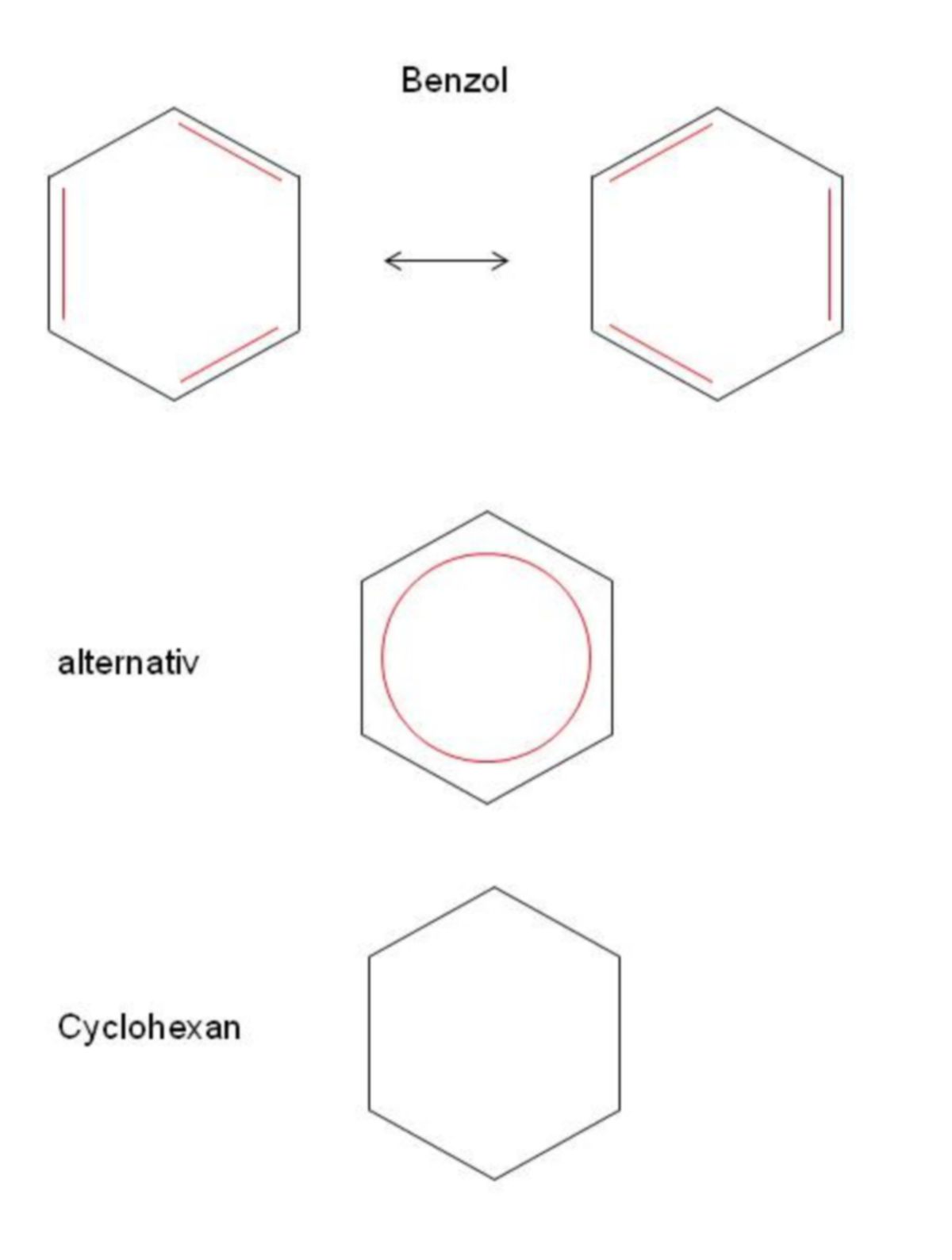
Benzol
Um die Aromatizität beschreiben zu können, wendet man sich in der Chemie meist dem einfachsten Vertreter der Aromaten, dem Benzol, zu. Es weist als Sechseck an allen sechs C-Atomen sp2-Hybridisierungen auf. Die sechs einfach besetzten p-Orbitale stehen senkrecht zu der Ebene, in der die C-Atome liegen. Sie überlappen sich und bilden π-Orbitale, die mit insgesamt sechs Elektronen besetzt sind und zu einer völlig gleichmäßigen Elektronenverteilung oberhalb und unterhalb des Sechserrings führen.
| Ein Ringsystem ist dann aromatisch, wenn es durchgehend konjugierte Doppelbindungen und [4n+2] π-Elektronen enthält. |
|---|
Auf Grund der Delokalisierung der π-Elektronen gibt es im Benzol keine Doppel- und Einfachbindungen mehr. Der vorhandene Sechsring ist symmetrisch und alle C–C-Bindungen sind gleich lang (0,139 nm) und somit kürzer als C–C-Einfachbindungen (0,154 nm) und zugleich länger als normale C=C-Doppelbindungen (0,133 nm). Diese Besonderheit des Benzols erfasst man, indem man die beiden möglichen Strukturformeln vergleicht, die sich lediglich in der Verteilung der Doppelbindung unterscheiden. Die Elektronenverteilung liegt sozusagen "zwischen" den Strukturformeln. Der Einfachheit halber wird oft nur eine der Formeln gezeichnet. Eine weitere gebräuchliche Schreibweise für das Benzol ist ein Sechsring mit einem Kreis in der Mitte.
Aromatische Ionen
Betrachtet man das Cyclopropenium-Kation und das Cyclopentadienyl-Anion, so erfüllen diese mit 2 (n=0) bzw. 6 (n=1) π-Elektronen die Hückel-Regel. Sie stellen deshalb besonders stabile Ionen dar. Cyclopentadienyl ist ein wichtiger einfach negativ geladener Ligand in der Organometallchemie.
Einschränkungen
- Es muss beachtet werden, dass die Hückel-Regel nur für monozyklische Moleküle gilt. Grund dafür ist, dass nur dort die Hückel-Näherung eine allgemeine Aussage machen kann, da sich die Energieschemata dieser Verbindungen besonders leicht berechnen lassen. Jedoch trifft sie keine Aussage über Systeme, die mehrere Ringe enthalten, wie es zum Beispiel bei polyzyklischen aromatischen Kohlenwasserstoffen (PAK) der Fall ist.
- Gemäß der Hückel-Regel verhalten sich folgende PAK's:
- Naphthalin (10 e-)
- Anthracen (14 e-)
- Phenanthren (14 e-)
- Diese PAK's verhalten sich entgegen der Hückel-Regel:
- Pyren (16 e-)
- Benzpyren (20 e-)
- Fluoranthen (16 e-)
- Die Regel gilt nur bei Molekülen, die zwei Seiten aufweisen. Weist das Molekül nur eine Seite auf, wie beispielsweise ein Möbiusband, so verschwindet die Aromatizität. Man kennt mittlerweile Moleküle, die beide Eigenschaften (Ein- und Zweiseitigkeit) aufweisen können, je nachdem in welchem Stoff sie gelöst sind.